서 론
재료 및 방법
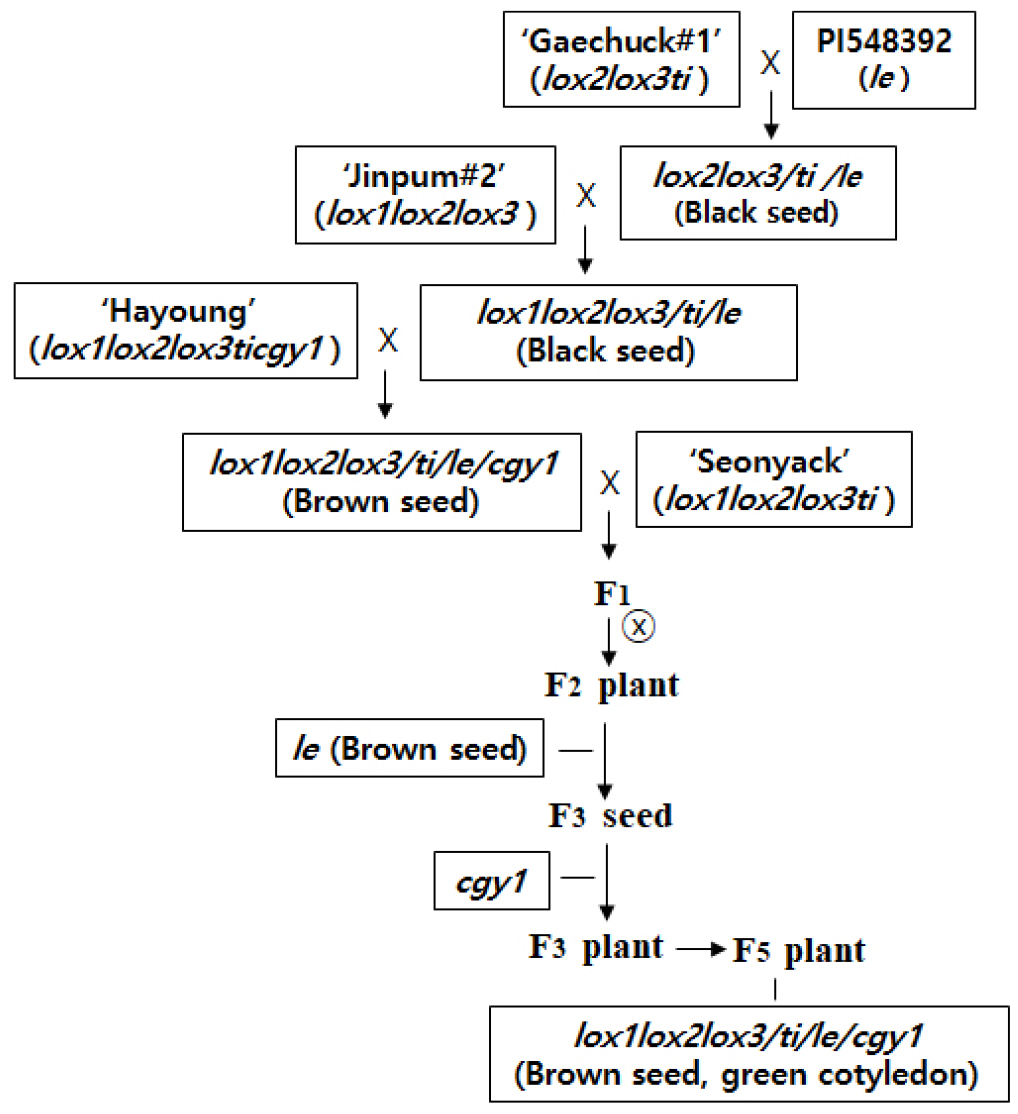
모본 및 교배집단 창성과 계통 선발
DNA 마커를 이용한 lele 유전자형 F2 개체 선발
7S α′ subunit 단백질 부재 F3 종자 선발
선발 계통에 대한 tetra null 유전자형의 검정
결과 및 고찰
갈색종피와 녹색자엽을 가진 lele 유전자형 F2 개체 선발
갈색종피와 녹색자엽 및 7S α′ subunit 단백질 부재 F3 종자 선발
선발 계통에 대한 tetra null 유전자형 검증 및 종자 형질
적 요
서 론
콩[Glycine max (L.) Merr. 2n=40]은 양질의 식물성 단백질과 지방을 얻기 위하여 재배되는 대표적인 두과작물이다. 성숙 종실에는 일반적으로 단백질 40%, 지방 21, 수용성 탄수화물 11% 정도의 영양소가 함유되어져 있다(Openshaw & Hadley, 1978). 밥밑용, 콩자반, 떡속, 제과용으로 널리 이용되고 있으며, 여러 가지 기능성을 가진 플라보노이드 성분이 들어있는 갈색 종피를 가진 유색콩 품종은 노란콩 품종보다 항산화 효과가 높아 소비가 점차 증가할 것으로 예상된다(Bae & Moon, 1997). 그러나, 갈색콩의 종실에는 알러지를 유발하고 소화불량을 초래하거나 가공적성을 저하시키는 lectin, 7S α′ subunit, lipoxygenase, Kunitz Trypsin Inhibitor (KTI) 단백질 같은 항영양성분이 다수 포함되어져 있다.
콩 종실에 있는 lectin 단백질은 galactose 또는 N-acetylgalactosamine에 특이적으로 결합하는 당단백질로 분자량이 120 kDa이며 대표적인 항영양성분으로 알려져 있다(Pull et al., 1978). 렉틴 단백질은 종실에 존재하는 전체 단백질 중 약 1-2% 정도이며 분자량이 30 kDa인 4개의 서브유닛으로 구성되어져 있다(George et al., 2008). Lectin 단백질은 섭취 시 소화효소에 의해 쉽게 분해가 되지 않으며, 소화되지 않은 lectin은 장내의 상피세포와 결합하여 구조와 기능을 손상시켜 장내 환경에 부정적인 영향을 야기하고 양분의 소화와 흡수를 방해하는 것으로 알려져 있다(Pan et al., 2018; Vasconcelos & Oliveira, 2004). 또한 lectin 단백질은 섭취 시 독성으로 인해 구토, 설사, 메스꺼움 같은 증상을 야기하는 것으로 보고되고 있다(Miyake et al., 2007). Lectin 단백질은 90°C에서 40분 가열 후에도 상당한 양이 활성을 가지는 것으로 알려져 있다(Pusztai & Grant, 1998). 콩 성숙 종실에서 lectin 단백질의 존재여부는 Le(le) 단일유전자에 의하여 좌우되며, lele의 열성 동형접합형일 때는 lectin 단백질이 존재하지 않은 것으로 알려져 있다(Orf et al., 1978). 콩 종실 단백질에서 7S globulin (ß-conglycinin)과 11S globulin (glycinin)은 전체 저장단백질의 약 70%를 차지한다(Tsukada et al., 1986). ß-conglycinin은 glycinin에 비하여 함황아미노산인 methionine, cystein, tryptophan의 함량이 5-6배 정도 더 낮아 콩 단백질의 영양적 가치를 크게 떨어뜨린다. 또한, ß-conglycinin은 α′, α 그리고 ß subunit로 구성되어져 있고(Thanh & Shibasaki, 1978), 섭취 시 알레르기를 일으키는 것으로도 알려져 있다(Krishnan et al., 2009). 7S β-conglycinin의 α', α, β subunit들은 각각 Cgy1, Cgy2, Cgy3 유전자에 의해 발현된다고 보고되어져 있다(Davies et al., 1985). 이 중 α' subunit을 발현시키는 Cgy-1 유전자가 모두 열성인 cgy1cgy1의 형태일 경우에는 종실에서 α' subunit 단백질이 존재하지 않으며, 유전자원으로는 ‘Keburi’가 보고되어져 있다(Kitamura & Kaizuma, 1981; Kitamura et al., 1984).
Lipoxygenase는 콩에서 비린맛을 유발시키는 대표적인 비영양적 효소로써, L-1, L-2, L-3의 3가지 isozyme으로 구성되어 있다(Kitamura et al., 1983). Lox1, Lox2, Lox3 유전자에 의해 지배되는 것으로 알려진 각 효소는 불포화 지질의 hydroperoxidation을 촉매하여 이로 인해서 생성된 lipid hydroxide와 그의 분해산물인 aldehyde, epoxides, ketones 등이 콩에서 비린 맛과 좋지 않은 맛을 유발 시킨다. Lox1, Lox2, Lox3 유전자는 단일 유전자 형태로 유전되며 lox1, lox2, lox3와 같이 열성일 때 종실에서 각각 L-1, L-2, L-3 단백질이 만들어지지 않는다(Hildebrand & Hymowitz, 1982; Davies & Nielsen, 1986; Kitamura et al., 1983). Lox1 및 Lox2는 서로 밀접하게 연관되어 있으며, Lox3는 Lox1 및 Lox2와 독립적인 것으로 알려져 있다(Davies & Nielsen, 1986). 성숙 콩 종실에는 trypsin의 단백질 가수분해 작용을 억제하여 단백질의 소화를 방해하는 21.5 kDa 분자량과 181개의 아미노산으로 구성되어진 Kunitz Trypsin Inhibitor (KTI) 단백질이 존재한다(Kunitz, 1945, 1946). KTI 단백질의 활성은 췌장 비대증을 유발하며, 50~60% 정도의 단백질 분해 활성을 감소시키고 열 처리된 콩 제품에서도 KTI 억제 활성이 최대 30%까지 확인되는 것으로 알려져 있다(Rackis & Gumbmann, 1981; Krogdahl & Holm, 1981). 성숙 종실에서 KTI 단백질의 존재여부는 Ti로 명명된 단일 유전자에 의해 지배되며 titi 유전자형에서는 종실에서 KTI 단백질이 존재하지 않는다(Orf & Hymowitz, 1979).
갈색종피를 가진 품종이나 자원에 존재하는 이러한 항영양성분들은 고온이나 첨가제 처리에 의하여 불활성화가 가능하지만, 가공상 추가비용이나 필수 아미노산 및 유용 성분 파괴와 같은 단점이 수반된다. 따라서, 갈색종피와 녹색자엽의 형질은 유지하면서 이러한 항영양성분이 유전적으로 제거된 계통 선발이 필요하다. 현재까지 갈색종피를 가진 육성 품종으로 ‘갈미’, ‘진율’이 있지만 모두 성숙 자엽은 노란색이다. 녹색자엽과 갈색종피이면서 항영양성분이 제거된 계통에 대한 보고는 없는 편이다. 본 연구는 성숙 종실에서 녹색 자엽을 가지면서 lectin, 7S α′ subunit, lipoxygenase 및 KTI의 4가지 단백질이 모두 없는 tetra null 유전자형을 가진 갈색 계통을 선발하기 위하여 진행되었다.
재료 및 방법
모본 및 교배집단 창성과 계통 선발
녹색자엽을 가지면서 기능성, 영양성과 가공 적성을 저하시키는 lectin, 7S α′ subunit, lipoxygenase 및 KTI의 4가지 단백질이 모두 없으면서 갈색종피와 tetra null 유전자형 (lecgy1lox1lox2lox3ti)을 가진 계통을 선발하기 위하여 4개의 품종과 1개의 유전자원이 모본으로 이용되었다. 5개의 모본에 대한 종피색, 성숙 자엽색 및 항영양성분에 대한 형질은 Table 1과 같다.
Table 1.
Seed coat, cotyledon color, and presence (+) or absence (-) of lipoxygenase, KTI, lectin, and 7S α′ subunit proteins of five parents used in this study.
‘개척1호’ x PI548392의 교배를 통하여 F2 종자를 얻은 후 개개의 종자를 이용하여 검정종피와 lectin, lipoxygenase-2, 3 및 KTI 단백질이 부재한 종자를 선발하였다. 선발된 F2 종자를 파종하여 F2 식물체로 전개시킨 후 형질이 양호한 개체를 선발하여 F3 종자를 수확하였다. 수확된 종자를 이용하여 검정종피와 lectin, lipoxygenase-2, 3 및 KTI 단백질의 부재를 확인한 후 lelox2lox3ti 유전자형을 가진 선발 개체로 이용하였다. ‘진품2호’와 선발 개체의 교잡으로 F2 종자를 얻은 후 검정종피를 가진 종자를 선발하였다. 선발된 개개의 종자에서 lectin, lipoxygenase 및 KTI 단백질이 부재한 F2 종자를 선발하였다. 선발된 F2 종자를 파종하여 F2 식물체로 전개시킨 후 형질이 양호한 개체를 선발하여 F3 종자를 수확하였다. 수확된 F3 종자에서 검정종피와 lectin, lipoxygenase 및 KTI 단백질의 부재를 확인 한 후 lelox1lox2lox3ti 유전자형을 가진 선발 개체로 이용하였다. ‘하영’과 선발 개체와의 교배로부터 F1 종자를 얻은 후 F1 식물체를 거쳐 F2 종자를 얻었다. 얻어진 종자중에서 갈색종피를 가진 F2 종자를 선발하였다. 선발된 개개의 F2 종자를 대상으로 lectin 및 7S α′ subunit의 2가지 단백질이 모두 없는 종자를 선발하였다. 선발된 F2 종자를 파종하여 F2 식물체로 전개시킨 후 형질이 양호한 개체를 선발하여 F3 종자를 수확하였다. 수확된 F3 종자에서 갈색종피를 확인 한 후 lectin, 7S α′ subunit, lipoxygenase 및 KTI의 4가지 단백질에 대한 부재를 확인하였다. 갈색종피와 lecgy1lox1lox2lox3ti 유전자형을 가진 선발개체를 모본(P1)으로, 검정종피 및 녹색자엽을 가지면서 lipoxygenase 및 KTI의 2가지 단백질이 부재한 ‘선약’을 부본(P2)으로 교배를 통하여 F1 종자 획득 후 F1 식물체로 양성하였다. 잡종성을 확인한 후 F1 식물체로부터 F2 종자를 얻었다. 각각의 F2 종자를 이용하여 갈색종피와 녹색자엽을 가진 F2 종자를 파종하여 F2 식물체 집단으로 전개하였다. 각각의 F2 식물체 중에서 DNA 마커를 이용하여 lectin 단백질이 부재한 lele 유전자형을 가진 개체를 선발하였다. 선발된 F2 식물체를 수확 한 후 개개의 F3 종자를 이용하여 7S α′ subunit 단백질이 부재한 cgy1cgy1 유전자형을 가진 종자를 선발하였다. 선발된 종자는 F3 식물체로 유지되면서 초형, 경장, 성숙기, 백립중등 양호한 3개의 개체가 선발되었다. 선발 개체는 F4 계통 및 F5 계통으로 유지되었다. F5 계통을 수확한 후 임의의 종자를 이용하여 lectin, 7S α′ subunit, lipoxygenase 및 KTI의 4가지 단백질에 대한 부재를 검정하였다. F5 계통중에서 형질이 양호한 한 개의 계통에 대하여 종피색, 성숙 자엽색, 백립중등을 조사하였다. 갈색종피, 녹색자엽 및 tetra null 유전자형을 가진 계통의 선발과정은 Fig. 1과 같다.
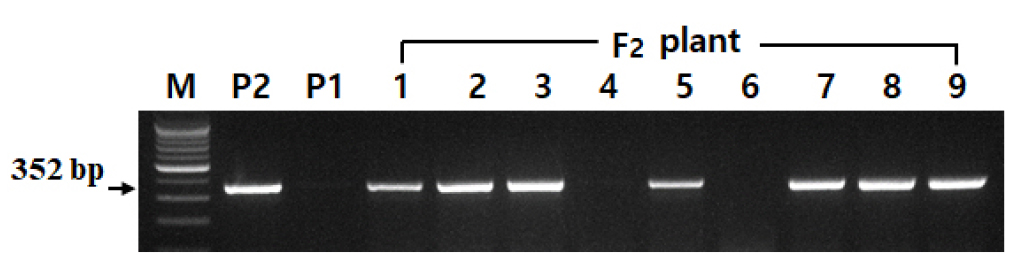
DNA 마커를 이용한 lele 유전자형 F2 개체 선발
성숙 콩 종자에서 lectin 단백질의 존재여부를 결정하는 Le(le) 유전자 염기서열에 기반한 DNA 마커를 이용하여 F2 식물체 중에서 lele 유전자형을 가진 개체를 선발하였다 (Rita et al., 2006). 모본 및 개개의 F2 식물체의 어린잎으로부터 genomic DNA를 이전의 연구와 동일한 방법으로 추출하였다(Rogers & Bendlich, 1994; Choi et al., 2017). Primer는 Forward primer:5ˊ-GACACTTTCC GGAACTCT TGGGATC-3ˊ, Reverse primer:5ˊ-CCAAAGGATCAATG TTACT GCTAGCGT-3ˊ)로 디자인하여 PCR을 실시하였다. PCR 반응액의 조성은 각 sample 당 DNA 2.5 μl, Water 16.5 μl, AccuPower® PCR PreMix [Top DNA Polymerase: 1U, dNTPs (dATP, dCTP, dGTP, dTTP) Each 250 µM, Reaction buffer with 1.5 mM MgCl2], forward와 reverse primer 각 0.5 μl씩 혼합하여 총 20 μl volume이 되게 하였다. PCR은 95°C 30s (denature), 62°C 30 s (annealing), 72°C 30s (extension)의 조건으로 31회 반복 실행되었다. PCR 완료 후 DNA가 증폭된 후 2% agarose gel (1 X TAB buffer 100 ml 당 agarose 2 g, ETBR 3 μl)에 loading하였고, 120 V 조건에서 25분간 전기영동을 실시하였다. 전기영동 완료 후 352 bp에서 band의 유무로 lele 유전자형을 가진 F2 개체를 선발하였다.
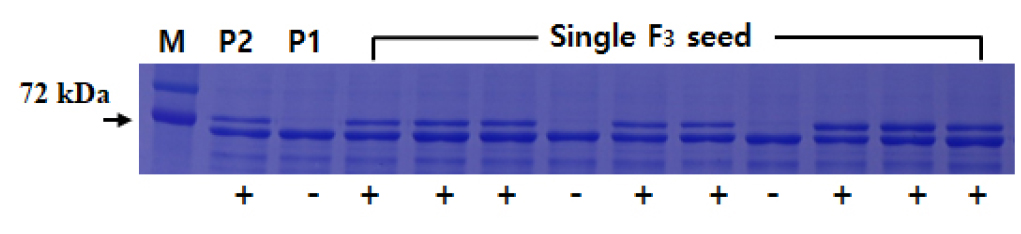
7S α′ subunit 단백질 부재 F3 종자 선발
성숙 콩 종실에서 lectin 단백질이 부재한 lele 유전자형을 가진 선발 F2 개체로부터 얻어진 개개의 F3 종자를 이용하여 SDS-PAGE 방법으로 7S α′ subunit 단백질이 부재한 종자를 선발하였다. 모본 및 개개의 F3 종자로부터 단백질 추출 및 전기영동은 이전의 연구와 동일하였다(Choi et al., 2021). 전기영동이 끝난 gel은 염색과 탈색 후 72 kDa의 7S α′ subunit 단백질 존재 여부로 선발하였다.
선발 계통에 대한 tetra null 유전자형의 검정
갈색종피 및 녹색자엽과 tetra null 유전자형을 가진 F5 계통의 수확 종자와 대조품종으로 검정종피와 녹색자엽을 가진 ‘청자3호’의 종자를 이용하여 lectin, 7S α′ subunit, lipoxygenase 및 KTI의 4가지 단백질에 대한 tetra null 유전자형을 검정하였다. 7S α′ subunit 및 lipoxygenase 단백질 부재는 SDS-PAGE 방법으로 검정하였으며, lectin 및 KTI 단백질 부재는 Western Blot 방법으로 확인하였다. 선발 계통과 ‘청자3호’의 종자로부터 단백질 추출과 전기영동은 이전의 연구와 동일한 방법으로 진행되었다(Choi et al., 2021). 7S α′ subunit 및 lipoxygenase 단백질은 각각 72 kDa와 97 kDa에서 부재가 검정되었고, lectin 및 KTI 단백질은 각각 120 kDa와 21.5 kDa에서 부재가 확인되어 tetra null 유전자형으로 검정되었다.
결과 및 고찰
갈색종피와 녹색자엽을 가진 lele 유전자형 F2 개체 선발
종피색이 갈색이면서 lectin, 7S α′ subunit, lipoxygenase 및 KTI의 4가지 단백질이 모두 없는 tetra null 유전자형 (lecgy1lox1lox2lox3ti) 개체와 검정종피와 녹색자엽이면서 lipoxygenase 및 KTI의 2가지 단백질이 모두 없는 ‘선약’과의 교배를 통하여 얻어진 F2 종자 중에서 갈색종피와 녹색자엽을 가진 전체 58개의 F2 식물체가 얻어졌다. 개개의 F2 식물체는 Le(le) 유전자 마커에서 분리를 나타내었다(Fig. 2).
전체 58개의 F2 식물체에 대한 Le(le) 유전자 마커 분리 결과는 Table 2와 같다.
얻어진 58개의 F2 식물체 중에서 성숙 종실에서 lectin 단백질이 존재하는 Le_ 유전자형을 가진 개체는 47개였으며, 11개의 개체는 lectin 단백질이 부재한 lele 유전자형을 가진 것으로 나타나 3:1 비율에 적합하였다(χ2 value: 1.127, P value: 0.5–0.1). 이러한 결과는 성숙 종실에서 lectin 단백질의 존재 여부는 single 유전자에 의해 좌우된다는 이전의 연구결과와 일치하였다(Orf et al., 1978).
Table 2.
Segregation of DNA marker for Le(le) allele in the F2 generation.
| Le(le) | No. of F2 plant |
χ2 value (3:1) | P | |
| Observed | Expected | |||
| Le_ | 47 | 43.5 | 1.127 | 0.5-0.1 |
| lele | 11 | 14.5 | ||
갈색종피와 녹색자엽 및 7S α′ subunit 단백질 부재 F3 종자 선발
lele 유전자형을 가진 11개의 F2 식물체 중에서 농업 형질이 가장 양호한 한 개의 선발개체로부터 33개의 F3 종자를 얻었다. 각각의 F3 종자에서 7S α' subunit 단백질은 분리되었다 (Fig. 3).
갈색종피와 녹색자엽을 가지면서 7S α′ subunit 단백질이 존재하지 않는 7개의 F3 종자를 선발하였다. 이러한 결과는 선발된 한 개의 F2 개체가 성숙 종실에서 7S α′ subunit 단백질의 유무를 결정하는 Cgy1(cgy1) allele이 heterozygote한 상태임을 나타내었고, 7S α' subunit 단백질의 존재 여부는 단일 유전자에 의해 좌우된다는 이전의 연구결과와 일치하였다(Kitamura et al., 1984). 선발된 7개의 F3 종자는 파종되어 F3 식물체로 유지되었다. 초형, 경장, 성숙기, 백립중등 농업형질이 양호한 3개의 F3 식물체가 선발되었다. 선발 개체는 각각 3개의 계통(S1, S2, S3)으로 유지되었다.
선발 계통에 대한 tetra null 유전자형 검증 및 종자 형질
갈색종피와 녹색자엽 및 tetra null 유전자형을 가진 3개의 선발 계통은 F5 계통으로 세대진전되었고, F5 계통의 수확 종자에서 lectin, 7S α′ subunit, lipoxygenase 및 KTI의 4가지 단백질 부재에 대한 검증은 Fig. 4와 같다.

Fig. 4.
Confirmation of absence of lipoxygenase and 7S α′ subunit (a), KTI (b), and lectin (c) proteins in mature seeds of the selection lines (S1, S2, and S3) with a brown seed coat, green cotyledon, and tetra- null genotype (lecgy1lox1lox2lox3ti). Arrows indicate 7S α′ subunit of 72 kDa, lipoxygenase of 97 kDa, KTI of 21.5 kDa, and lectin of 120 kDa. C: Check cultivar (‘Chungja#3’- LeCgy1Lox1Lox2Lox3Ti genotype).
대조품종으로 이용된 ‘청자3호’는 검정종피와 녹색자엽을 가지고 있으며 4가지 단백질에 대하여 LeCgy1Lox1Lox2Lox3Ti 유전자형을 가져 성숙 종실에서 lectin, 7S α′ subunit, lipoxygenase 및 KTI 단백질이 모두 존재하였지만, 3개의 선발 계통(S1, S2, S3) 종자에서는 4가지 단백질이 모두 부재하였다. 이러한 결과는 lectin, 7S α′ subunit, lipoxygenase 및 KTI 단백질의 존재여부는 single 유전자에 의해 좌우되며 열성일 경우 부재하여 선발과 함께 유전적으로 고정된 상태임을 나타내었다(Davies & Nielsen, 1986; Hildebrand & Hymowitz, 1982; Kitamura et al., 1983; Kitamura et al., 1984; Orf & Hymowitz, 1979; Orf et al., 1978). 3개의 선발 계통과 대조품종으로 이용된 ‘청자3호’에 대한 종자 관련 형질은 Table 3과 같다.
Table 3.
Seed-related traits of the check cultivar (‘Chungja#3’) and three selection lines (S1, S2, and S3) developed in this study.
대조품종인 ‘청자3호’는 검정종피와 녹색 자엽을 가진 반면, 선발된 3개의 계통에 대한 종피색은 모두 갈색이며 자엽색은 녹색이다. 배꼽색은 대조품종 및 선발 계통 모두 하얀색을 나타내었다. 선발 계통의 백립중은 26.4–30.9 g으로 대조품종인 ‘청자3호’의 36.0 g보다 작았다. 백립중이 가장 높은 S2 선발 계통의 성숙기 초형과 수확 후 F6 종자 모양은 Fig. 5와 같다.
본 연구를 통하여 선발된 3개의 계통중에서 S2 계통은 백립중이 30.9 g으로 대립이며, 화색은 자주색이고 유한신육형이며 협색은 갈색이고 경장은 약 65 cm 정도이다. 포장에서 6월 20일경 파종시 개화기는 8월 4일 정도이며 수확기는 10월 25일 정도이다. 콩에서 항영양성분으로 알려진 lectin, 7S α′ subunit, lipoxygenase 및 KTI의 4가지 단백질 모두 부재한 유색콩 품종육성을 위한 중간모본으로 이용될 수 있을 것으로 사료되었다.
적 요
갈색종피와 녹색자엽을 가진 품종 및 유전자원의 성숙 종실에는 눈 건강에 유익한 루테인 성분과 항산화 효과를 가진 플라보노이드 성분이 많이 함유되어져 있다. 그러나, 렉틴, 7S α′ subunit, 리폭시게나제 및 쿠니츠 트립신 억제제(KTI) 단백질 같은 항영양 성분이 존재한다. 이러한 항영양 성분을 불활성화시키기 위하여 콩 식품 제조 및 가공시 고온 및 첨가제 처리가 필요하지만 여러 가지 단점이 수반된다. 따라서, 갈색종피와 녹색자엽이면서 성숙 종실에서 렉틴, 7S α′ subunit, 리폭시게나제 및 KTI의 4가지 단백질이 모두 부재한 tetra null 유전자형(lecgy1lox1lox2lox3ti)을 가진 계통을 선발하기 위하여 본 연구가 진행되었다. 4개의 품종과 1개의 유전자원을 이용하여 육종집단 창성을 위한 두 모본이 선발되었다. 전체 58개의 F2 식물체로부터 DNA 마커를 이용하여 lele 유전자형을 가진 개체가 선발된 후 갈색종피와 녹색 자엽이면서 7S α′ subunit 단백질이 부재한 F3 종자가 선발되었다. 선발된 F3 종자는 F3 식물체를 거쳐 3개의 계통으로 육성되었다. 3개의 선발 계통(S1, S2, S3)에 대하여 F6 종자에서 렉틴, 7S α′ subunit, 리폭시게나제 및 KTI의 4가지 단백질에 대한 유전적 부재가 검정되었다. 3개의 선발 계통은 갈색종피, 녹색자엽 및 흰색배꼽을 가지고 있으며 백립중은 26.4–30.9 g으로 대조품종인 ‘청자3호’의 36.0 g보다 작았다. S2 선발 계통은 백립중이 30.9 g으로 대립이며 콩에서 항영양성분으로 알려진 lectin, 7S α′ subunit, lipoxygenase 및 KTI의 4가지 단백질 모두 부재한 유색콩 품종육성을 위한 중간모본으로 이용될 수 있을 것으로 사료되었다.