서 론
보리는 옥수수, 밀, 벼, 콩 다음의 세계 주요 5대 작물 중 하나로 맥주 등 가공용과 사료용으로 주로 이용되고 있으며(Baik & Ullrich, 2008), 최근에는 베타글루칸, 안토시아닌 등 기능성이 강조되면서 파스타, 플레이크, 스넥 등 가공용으로 연구가 진행되고 있다(Paula et al., 2017; Sullivan et al., 2013). 보리는 춘파용과 추파용, 2줄 보리와 6줄 보리, 종실에 껍질이 붙어 있는 겉보리(hulled)와 잘 벗겨지는 쌀보리(hull-less)로 구분 된다(Baik & Ullrich, 2008). 국내에서 6줄 겉보리는 엿기름, 보리차 등의 가공으로, 2줄 겉보리는 맥아 및 맥주제조용으로, 쌀보리는 국수, 빵 등의 가공과 혼반용으로 이용되고 있다.
맥주용 보리로는 단백질 함량이 낮고 전분함량이 높으면서 효소역가가 높은 2줄 겉보리가 품종으로 육성되어 왔다(Kang et al., 2016; Kang et al., 2017; Yoon et al., 2020). 맥아 및 맥주 제조시 중요한 품종의 특성은 순도이며, 이는 품종마다 수분 흡수율, 발아세, 발아율 등이 달라 맥아 제조시 미발아 종자가 품질 특성에 영향을 미치기 때문이다. 따라서 고품질 맥아 생산을 위해서는 종자의 순도 유지가 필요하며, 형태적 구분 등을 통한 품종의 구별이 이루어져야 한다(Hleba et al., 2019). 그러나 품종 육성시 교배 자원이 다양하지 않고 국내 계통을 이용한 교배가 주로 이루어지면서 품종의 다양성이 줄어들고 있다. 따라서, 품종 간 차별성을 확인하기 위해서는 형태학적 특성을 이용한 구분보다는 환경적 영향을 배제할 수 있는 유전적 특성을 이용한 구분 방법이 필요한 실정이다.
보리의 주요 저장단백질인 호데인 단백질은 전체 단백질의 40%를 차지하며 품종별로 고유한 유전적 특성을 보여 이를 이용한 품종 구분이 연구되어왔다. 호데인 단백질은 NaCl 등 염에 용해되는 수용성의 알부민과 글로블린, 알코올 등에 용해되는 플로라민, 산이나 염기에 용해되는 글루텔린으로 구분되어왔으며, 현재에도 이 구분법이 이용되고 있다(Osborne, 1924). 그리고 최근에는 분자량과 이황화결합정도에 기반을 두어 황이 풍부하면서 분자량이 28~45 kD인 B-hordeins (보리 전체 호데인의 70~80%), 분자량 49~72 kD의 황이 적은 C-hordeins (10~20%), 분자량이 100 kD근처인 high molecular weight (HMW) D-hordeins (5% 이하), 황이 풍부하고 분자량이 20 kD 이하인 γ-hordeins (5% 이하, A-hordeins으로도 표현)로 구분지어지고 있다(Celus et al., 2006; Villiers, 1988; Howord et al., 1996). γ-hordeins의 경우 진정한 저장단백질로 분류하지는 않고 있다(Salcodo et al., 1984). 호데인 중 함량이 많고 폴리펩타이드들이 다양성을 보이는 C-hordeins 과 B-hordeins이 보리 품종의 판별에 주로 이용되고 있다(Shewry et al., 1980; Hleba et al., 2019). 이러한 호데인의 추출용매로는 70% ethanol, 55% 1-propanol이 이용되고 있으며 이황화결합을 제거하여 용해성을 높이기 위해 1~2% Dithiothreitol (DTT)가 이용된다. 호데인 분석에는 acid-polyacrylamide gel electrophoresis (A-PAGE, Villiers & Laubscher, 1988), sodium dodecylsulfate polyacrylamide gel electroproresis (SDS-PAGE, Shewry et al., 1979), high-performance liquid chromatography (HPLC, Wingad et al., 1986; Marchylo & Kruger, 1985), matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF MS, Hleba et al., 2019; Šalplachta & Bobálová, 2009)가 이용되어왔다. HPLC는 물질의 구성과 양을 정량할 수 있는 분석법으로 보리의 호데인 분석에 의한 품종 확인과 맥아제조 과정에서의 호데인의 구성과 양의 변화를 함께 연구하는 데 이용되어왔다(Marchylo & Kruger, 1985; Jane & Skerritt, 1992). 또한 최근에는 펌프 압력을 높이고(40 Mpa → 100 Mpa) 컬럼 충진물 입자 크기를 작게 한(5 μm → 2 μm) ultra performance liquid chromatography (UPLC)가 물질의 분석에 이용되고 있는데, 이 분석법은 HPLC 보다 분석능이 우수하고 분석시간을 줄일 수 있는 장점이 있다. Han et al. (2015)과 Yu et al. (2013b)은 밀의 글리아딘과 글루테닌의 분석에 UPLC를 이용하여 분석 시간을 30분 이하로 단축시켰으며, Yu et al. (2013a)은 UPLC를 이용한 밀의 수용성 단백질 분석법이 HPLC보다 분석 시간도 짧고 분리능도 우수하였다고 보고하였다. 아직까지 보리 호데인단백질의 분석에 UPLC를 이용한 분석은 연구되어 있지 않으며, 이를 이용한 국내 맥주보리 품종의 판별에 관한 연구도 수행되어 있지 않다.
본 연구는 이황화결합이 적으면서 알코올에 용해성으로 추출법이 간단한 C-hordeins을 분석 시간이 짧고 분석능이 우수한 UPLC를 이용하여 분석하여 국내 육성된 맥주보리의 품종판별에 이용하고자 수행되었다.
재료 및 방법
맥주보리 품종
본 연구에 사용된 호품보리는 국립식량과학원(전주) 맥류재배 포장에서 전작 조건으로 표준시비(kg/10a, 밑거름 N-P2O5-K2O-퇴비=3.3-6.8-3.0-1,000, 웃거름 N=1.9)에 준하여 기본식물 증식용(웃거름은 월동 후 보리 생육 상태에 따라 질소비료 증감함)으로 2015년에서 2020년 재배된 종자가 이용되었다. 지역별 호데인 분석에 이용된 호품보리는 각 도원(전북, 전남, 경남, 경북, 충남, 제주)에서 2017년 수확한 종자로 재배 지역별 비료량(시비량)을 밑거름과 웃거름을 6:4로 하여 표준재배하였다(RDA, 맥주보리·농업기술길잡이, 2018). 맥주보리 26품종(Table 1)의 분석은 2016년에서 2017년 국립식량과학원(전주)에서 전작조건으로 표준재배에 준하여 재배한 보리를 이용하였다.
Table 1.
Varieties of Korean malting barley.
보리 호데인 추출
C-hordeins의 추출은 Han et al. (2015)의 추출방법을 참조하였으며, 보리 종실 1립을 200 μL 알콜성 추출용매 70% ethanol (EtOH)와 55% isopropyl alcohol (IPA, 2-propanol)로 각각 20°C, 200 rpm으로 2시간 교반 추출하였다(shaking incubator, VS-8480SFN, Vision, Korea). 이를 13,000 rpm으로 10분 동안 원심분리하고 상징액을 0.2 μm polyvinylidene fuoride (PVDF) filter로 여과하여 reversed-phase ultraperformance liquid chromatography (RP-UPLC)로 호데인 단백질을 분석하였다. B-hordeins은 알코올성용매에 1% DTT를 첨가하여 C-hordeins 추출과 같은 방법으로 이루어졌다. D-hordeins의 추출은 Yu et al. (2013b)의 밀 글루테닌 추출방법을 참조하였으며, 종자 1립을 500 μL 55% IPA를 이용하여 2회 추출하여 상징액을 제거하고, 100 μL 50% extraction buffer (50% isopropanol, 1M Tris-HCl (pH 8.0), 1% DTT)을 이용하여 65°C, 30분간 추출하였다. 추출이 끝난 후 알킬화를 위해 100 μL alkylation buffer (50% isopropanol, 1M Tris-HCl (pH 8.0), 1.4% 4-vinylpyridine)를 65°C에서 30분간 반응시켰다. 반응이 끝난 후 13,000 rpm에서 10분간 원심분리한 후 상징액만 따로 모아 -20°C 아세톤을 80%가 되도록 첨가한 후 -20°C 냉동고에 보관하였다(overnight). 침출된 호데인은 13,000 rpm으로 10분간 원심분리 한 후 상징액은 따라 버리고 후드에서 남은 아세톤을 모두 제거하였다. 고형화된 호데인은 21% acetonitrile (ACN)을 넣어 완전히 용해한 후 0.2 μm PVDF filter로 여과하고 RP-UPLC를 이용하여 분석한다.
보리 호데인 분석
RP-UPLC의 분석은 Waters ACQUITY UPLC® H Class (Waters Corp. Singapore)로 수행되었으며, 컬럼은 ACQUITY UPLC® Peptide BEH C18 column (300 Å, 1.7 μm, 2.1 mm × 50 mm, Waters Corp. Ireland), detector는 PDA (photodiode array, absorbance λ 210 nm, Waters Corp., Singapore)가 이용되었다. 실험은 Han et al. (2015)과 Yu et al. (2013b)를 변형하여 수행되었다. 이동상 용매는 0.1% trifluoroacetic acid (TFA) in water (A), 0.1% TFA in acetonitrile (B)로 용매 기울기 21% B에서 47% B로 0분에서 30분간 변화를 주었다. 컬럼 온도와 샘플 온도는 각각 55°C와 10°C로 하였다. 샘플 주입량은 추출용매 실험은 10 μl, 맥주보리 품종의 분석은 5 μl이었으며, 유속은 0.55 μl/min이었다.
크로마토그램의 분석은 Peak width 30, Threshold 50, Minimum area 10,000, Height 3,000을 적용하여 분석하였다.
통계분석
모든 분석은 3반복으로 수행되었으며, 통계프로그램 R (version 1.1.442, RStudio Inc.)의 t-검정을 이용하여 5% 유의수준에서 통계적인 차이를 구명하였다.
결과 및 고찰
국내 보리 품종의 호데인 분석
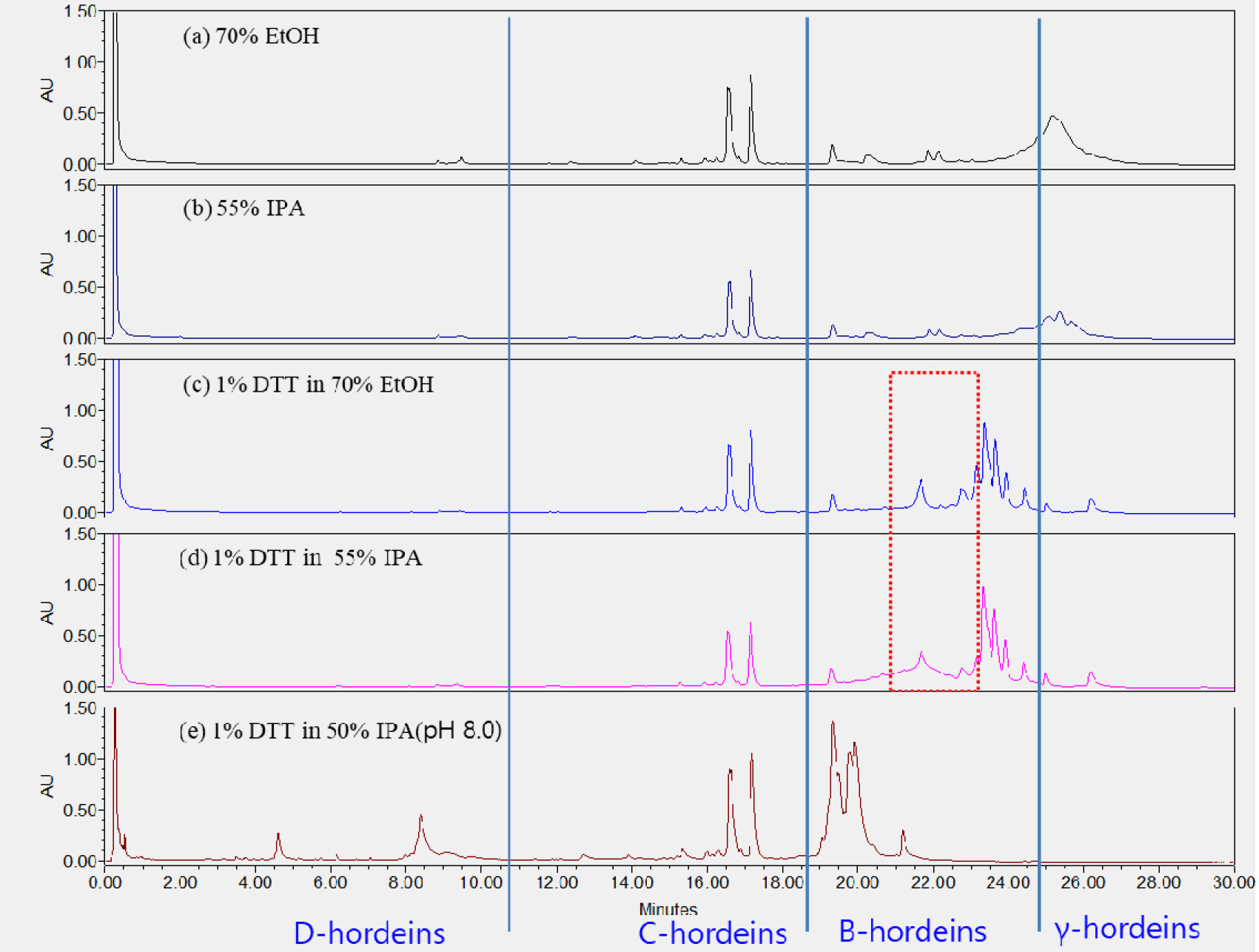
국내 육성 맥주보리 품종 호품의 추출용매에 따른 호데인 단백질의 구성을 분석하였다(Fig. 1). 70% EtOH (a)와 55% IPA (b)를 이용하여 추출한 호품의 호데인의 구성은 서로 일치하였으며, C-hordeins의 주피크(머무름시간 16.5분) 평균 면적과 높이는 55% IPA가 6,915,948 uV/S, 717,836 uV, 70% EtOH가 5,699,755 uV/S, 586,890 uV로 55% IPA가 더 넓고 높았지만 유의성은 없었다. 머무름 시간 17.1분의 피크 평균 면적과 피크 높이 또한 55% IPA용매에서 6,119,086 uV/S, 850,327 uV, 70% EtOH용매에서 5,012,373 uV/S, 711,391 V로 55% IPA 추출이 70% EtOH 보다 피크면적이 넓고 높이가 더 높았지만 이 값들 또한 유의하지 않았다. 보리의 C-hordeins은 EtOH (Hleba et al., 2019), IPA (Marchylo & Kruger, 1985), 1-propanol (Peter et al., 1992) 등의 알콜성 용매들이 추출에 이용되고 있으며, Šalplachta & Bobálová (2009)는 60% EtOH (2% DTT 함유)와 55% IPA (2% DTT 함유) 용매를 이용한 호데인 추출은 MALDI-TOF 분석에서 signal-to-noise의 차이만 있을 뿐 구성의 차이는 없었다고 하여 본 연구 결과와 같은 결과를 보였다.
B-hordeins은 알콜성 추출용매에 1% DTT를 첨가하여 폴리펩타이드 체인 내부 그리고 체인들 간의 이황화 결합을 절단하여 추출용매의 용해도를 높여 그 구성을 확인하였다(Fig. 1(c), (d)). DTT를 첨가한 알콜성 용매의 추출로 C-hordeins (머무름 시간 13분~20분)와 B-hordeins (머무름 시간 21분~25분)가 모두 분석되었다. B-hordeins은 보리 저장단백질의 70-80%를 차지하며 폴리펩타이드 내부와 폴리펩타이드들 간에 황이 풍부하다고 보고되어 있으며, 황의 절단에는 DTT (Marchylo & Kruger, 1985)와 β-mercaptoethanol (β-ME, Villiers & Laubscher, 1988) 등이 이용되고 있다. 크로마토그램에서 B-hordeins 영역은 70% EtOH (1% DTT 첨가) 추출물이 55% IPA보다 분리도가 좋게 나타났지만(머무름시간 21분~23분) 피크 구성의 차이는 보이지 않았으며, 이는 Šalplachta & Bobálová (2009)의 MALDI-TOF 분석에서 signal-to-noise가 60% EtOH 추출에서 55% IPA보다 좋았으나 구성의 차이는 없다고 한 결과와 같은 결과로 해석된다.
D-hordeins은 약산이나 약염기에서 용해가 된다고 보고되어 있어(Villiers & Laubscher, 1988), 호품을 약염기에서(pH 8.0) 추출, 분석하고 크로마토그램을 Fig. 1(e)에 나타냈다. D-hordeins 피크는 머무름 시간 4.5분, 8.5분에서 확인되었다. Radovic & Vapa (1996)는 SDS-PAGE를 이용한 유고슬라비아 보리 품종들의 호데인 분석에서 Hor3 유전자좌에 있는 D-hordeins는 2가지 패턴을 보였으며, C-hordeins는 8가지, B-hordeins는 7가지 패턴을 보였다고 하였다. Villiers & Laubscher (1988)는 D-hordeins의 경우 다양한 패턴을 보이지 않았으며, 또한 이들은 밴드가 약하거나 발견되지 않을 때도 있어 품종의 구분에는 이용할 수 없었다고 하였다. 그러나 C-hordeins (16밴드)와 B-hordeins (38밴드) 영역은 다양성이 많이 발견되어 품종의 확인에 이를 이용할 수 있다고 하였다.
보리 저장단백질인 호데인은 품종의 확인을 위해 A-PAGE, SDS-PAGE, HPLC, MALDI-TOF 등의 분석법이 이용됨이 보고되어왔다(Villiers & Laubscher, 1988; Shewry et al., 1979; Allison & Bain, 1986; Šalplachta & Bobálová, 2009). 보리 저장단백질의 70-80%와 10-20%는 B-hordeins와 C-hordeins로 이들은 품종별로 다양한 서브 유닛을 보인다고 보고되었다. 그러나 D-hordeins와 γ-hordeins는 보리 저장단백질의 5% 미만으로, D-hordeins는 품종별 다양성이 보고되지 않았으며, γ-hordeins은 진정한 저장단백질이 아니므로 품종 확인에 이용되지 않는다고 하였다(Radovic & Vapa, 1996; Illiers & Laubscher, 1988). B-hordeins는 폴리펩타이들 체인 내부와 체인 간 이황화결합이 풍부하여 알콜성 용매에 β-ME, DTT는 등 황의 결합을 절단할 수 있는 환원제 첨가로 추출이 가능하며, C-hordeins는 이황화결합이 적어 알콜성 용매로 추출이 가능하다고 하였다(Villiers & Laubscher, 1988; Marchylo & Kruger, 1985). 물질안전보건자료(material safety data sheets, MSDS)에서 β-ME는 발암성, 급성 독성물질이며, DTT는 눈과 피부, 호흡에 자극을 줄 수 있는 시약으로 본 연구에서는 EtOH를 이용한 C-hordeins 추출로 국내 육성 맥주보리 품종을 구분하고자 하였다. 또한 HPLC와 분석원리가 같으나 높은 압력과 작은 사이즈의 컬럼 충진물을 이용하는 UPLC 분석으로 호데인 분석시간을 줄이고자 하였다. Marchylo & Kruger (1985)는 HPLC를 이용한 호데인 분석이 전기전도도를 이용한 분석보다 더 많은 호데인 성분의 분리능을 보였다고 하였다. Allison & Bain (1986)는 HPLC를 이용하여 38개 유럽 보리 품종 중 26개를 구분할 수 있었으며, 이것은 SDS-PAGE 분석으로 160개 품종에서 32를 구분하는 것보다 더 효과적이었고, SDS-PAGE로 구분하지 못하는 품종의 구분도 가능하였다고 하였다. 이들 연구에서 HPLC를 이용한 호데인 분석은 60-100분이 소요되었으며, 본 연구에서는 호데인을 UPLC를 이용함으로써 30분 이하로 단축할 수 있었다.
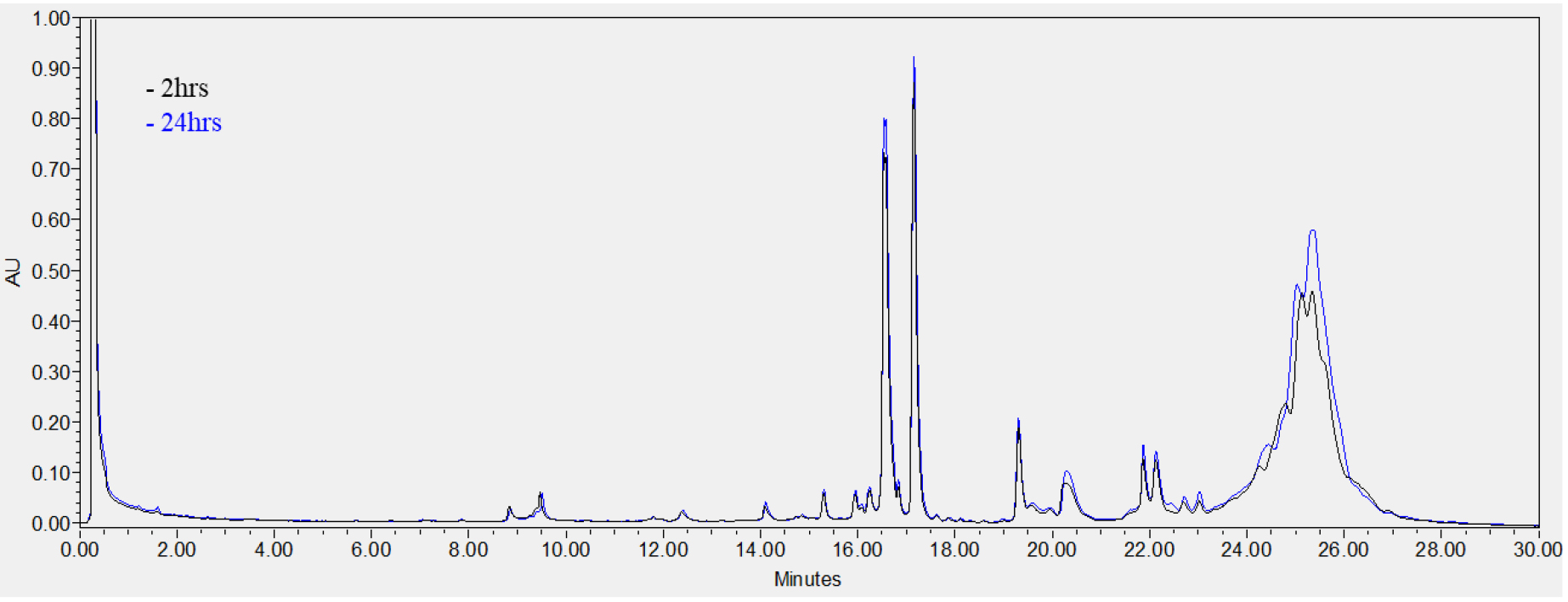
보리의 알코올 용해성 호데인(C-hordeins)의 추출시간에 대한 영향을 알아보기 위해 70% EtOH를 이용하여 2시간, 24시간 추출한 후 호데인을 분석하였으며 그 결과는 Fig. 2와 같다. 70% EtOH 용매에 대한 추출시간의 영향은 보이지 않아 2시간 추출로도 C-hordeins 구성을 확인할 수 있음을 알 수 있었다. 본 결과를 바탕으로 국내 맥주보리 품종의 C-hordeins 분석을 통한 품종 구분을 위해 추출용매는 70% EtOH, 추출시간은 2 hr으로 하여 UPLC를 이용하여 저장단백질을 분석하였다.
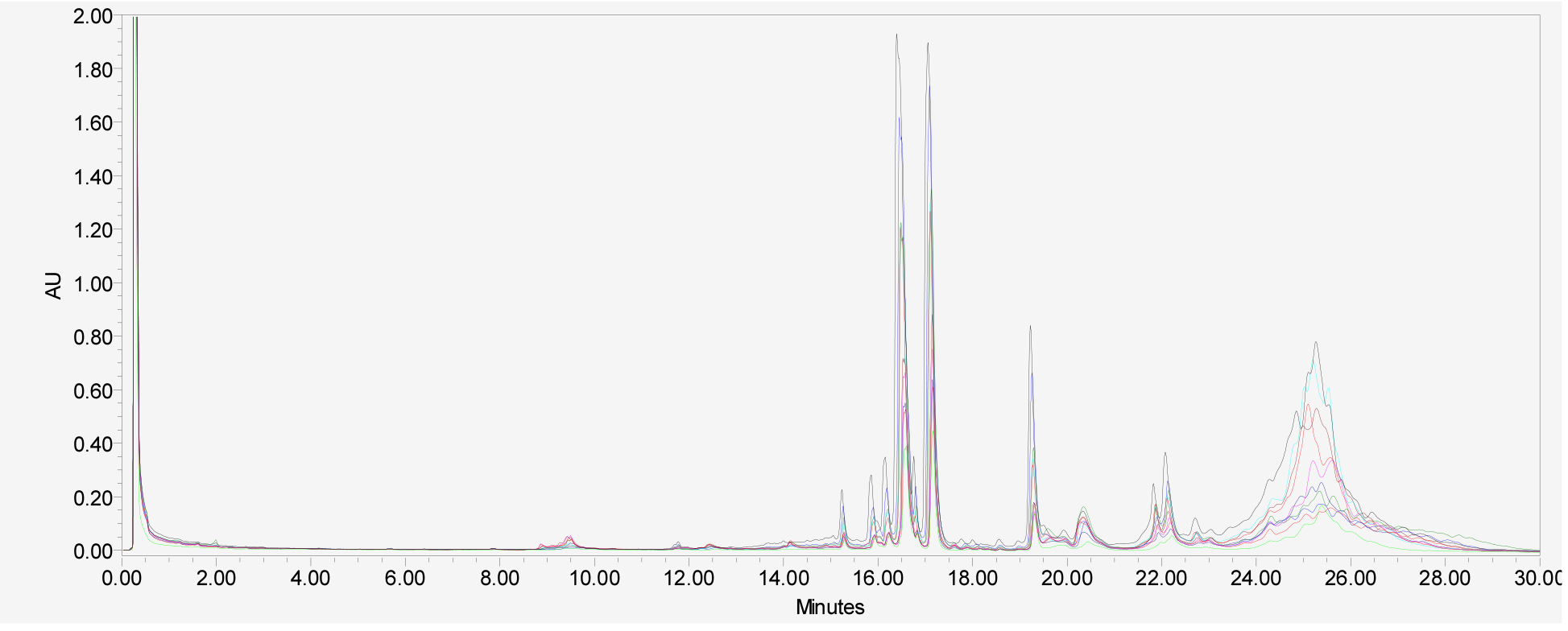
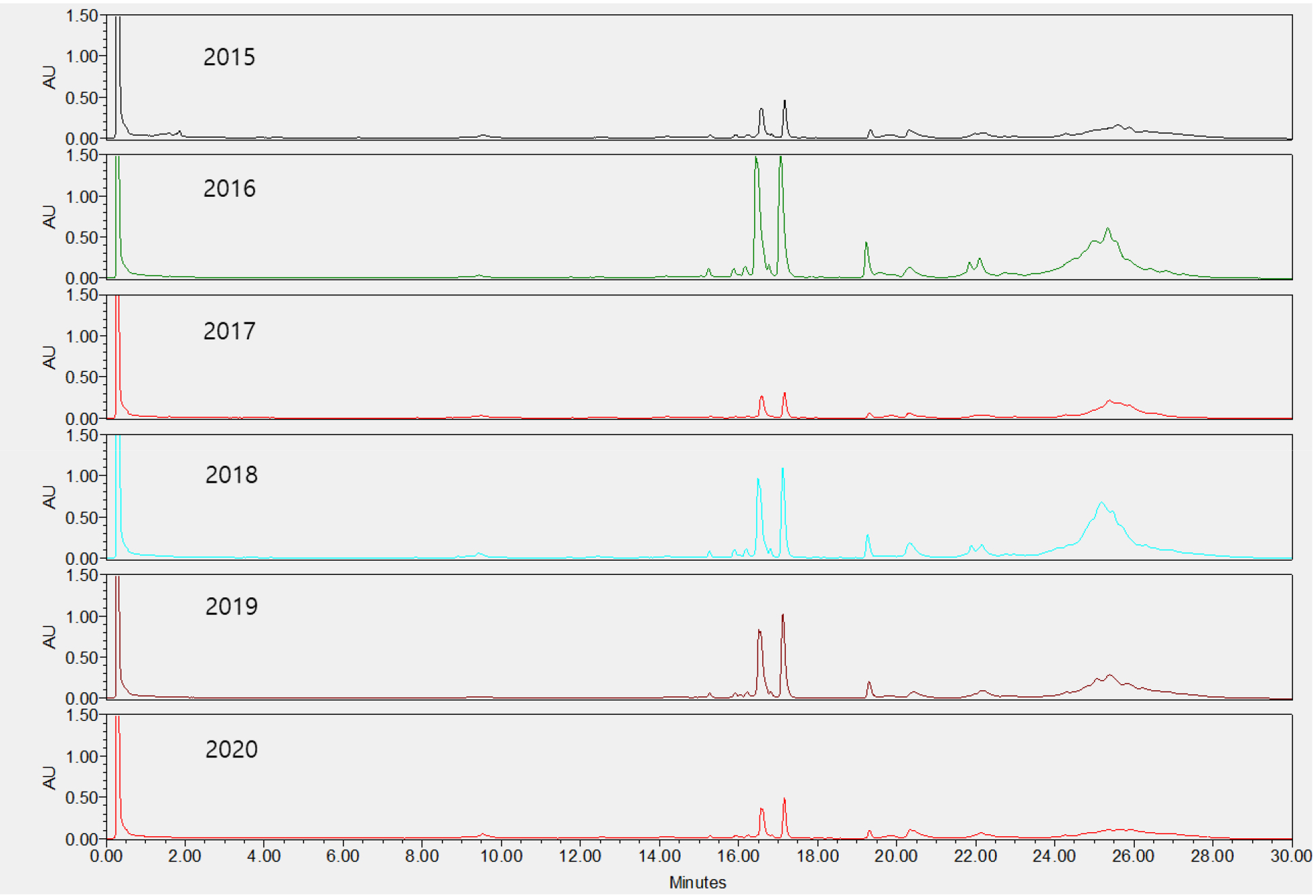
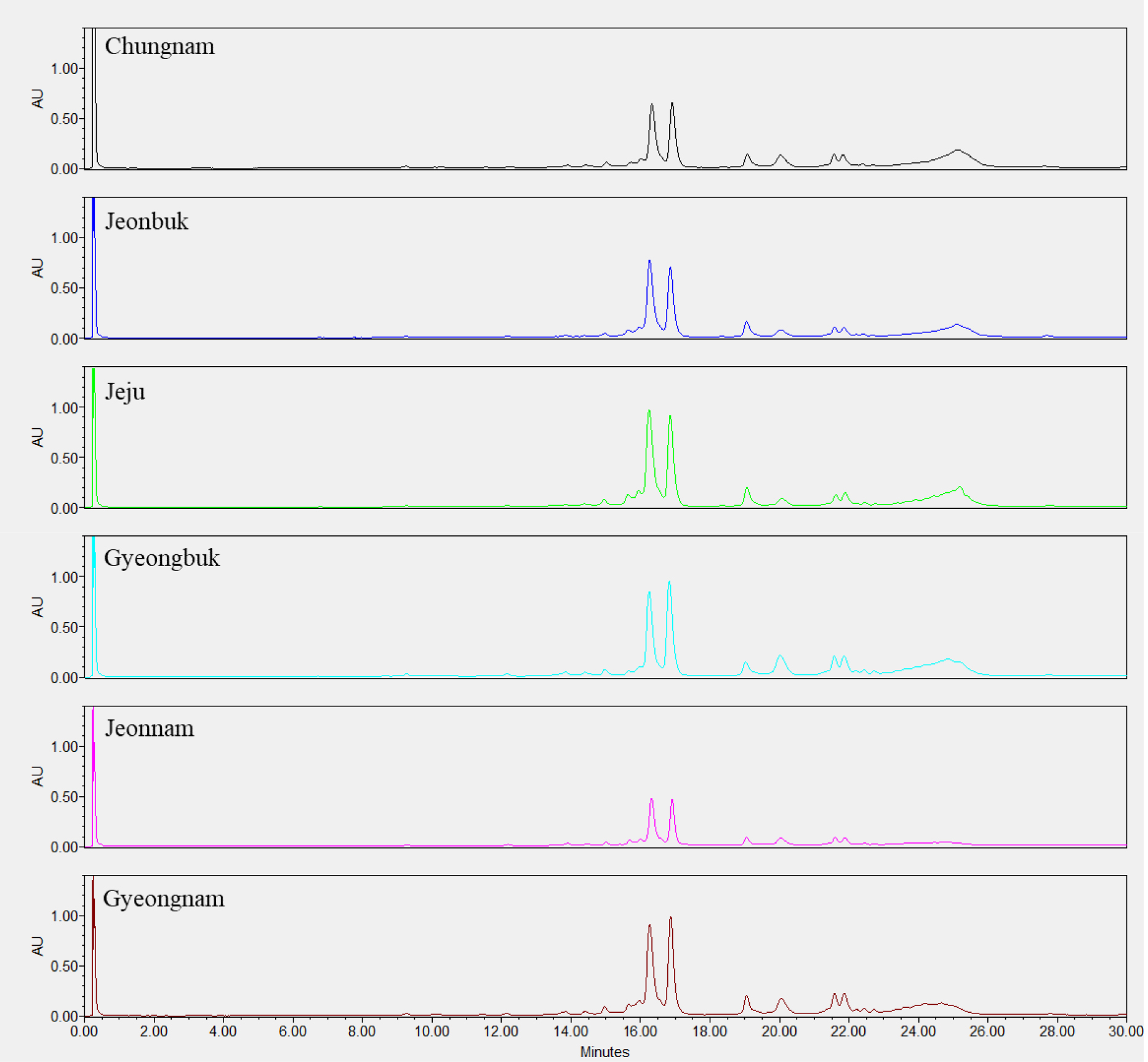
단일 품종의 종자들 간의 호데인 구성 변이를 확인하기 위해 2017년 수확한 호품 종자 10립 각각의 C-hordeins을 분석하였다(Fig. 3). 종자 크기가 다른 호품 1립들은 단백질 함량 차이로 피크 높이와 면적은 달랐지만 피크 구성은 일치함을 알 수 있었다. Fig. 4는 2015년에서 2020년에 생산된 연도별 호품 1립들의 호데인 단백질을 분석한 크로마토그램으로 연차별 호데인 구성은 변하지 않고, 단백질의 양만 변화가 있었음을 확인할 수 있었다. 본 연구에서는 지역별(전북, 전남, 경남, 경북, 충남, 제주) 재배된 호품의 호데인 단백질 구성 또한 확인 하였는데(Fig. 5), 호품의 C-hodeins는 지역별로 양적인 차이만 있을 뿐 구성의 차이는 없음을 알 수 있었다. 본 결과는 보리 저장단백질인 C-hordeins 구성이 품종의 유전적 특성으로 환경적 영향을 받지 않음을 알 수 있게 한다.
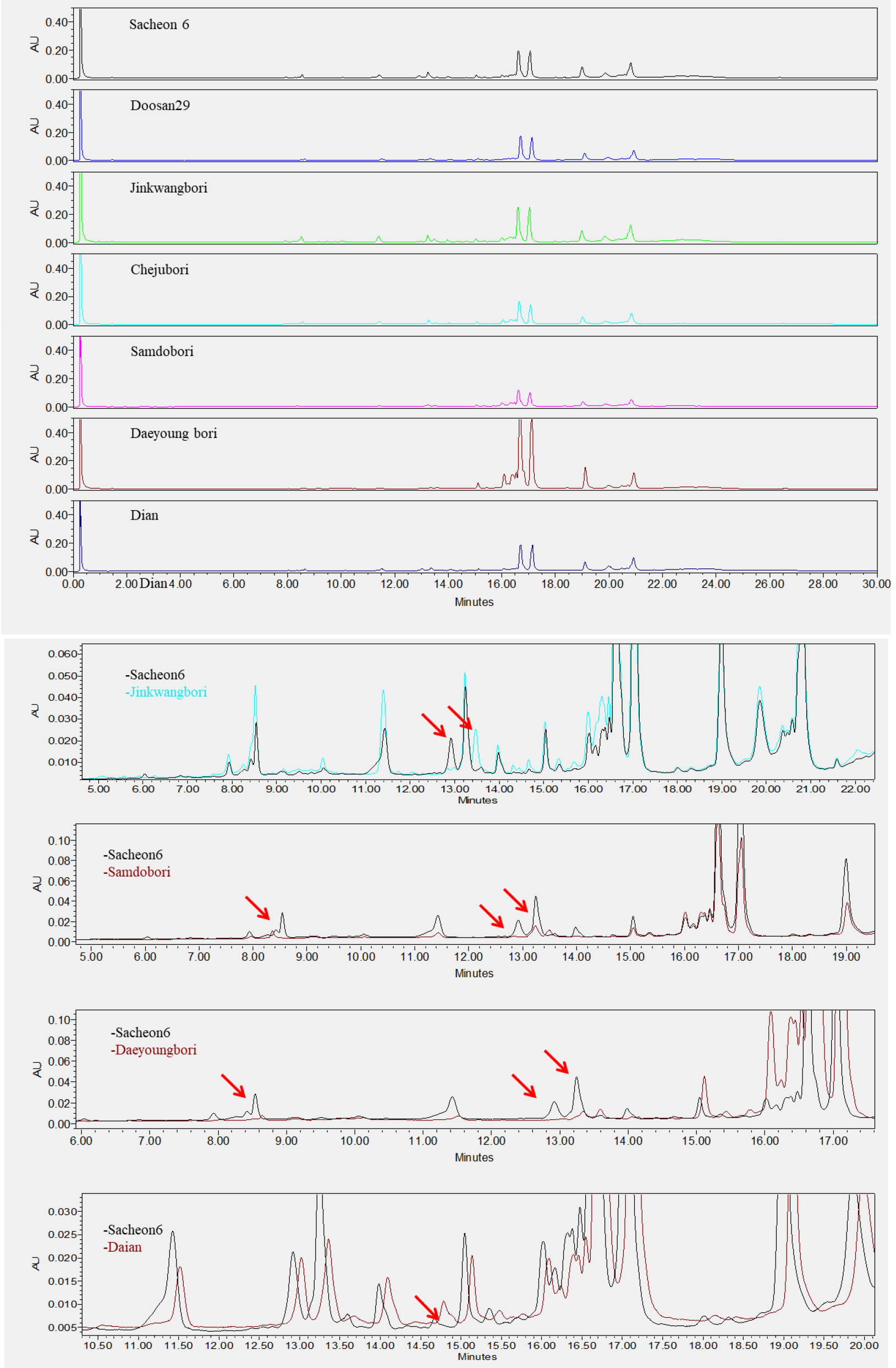
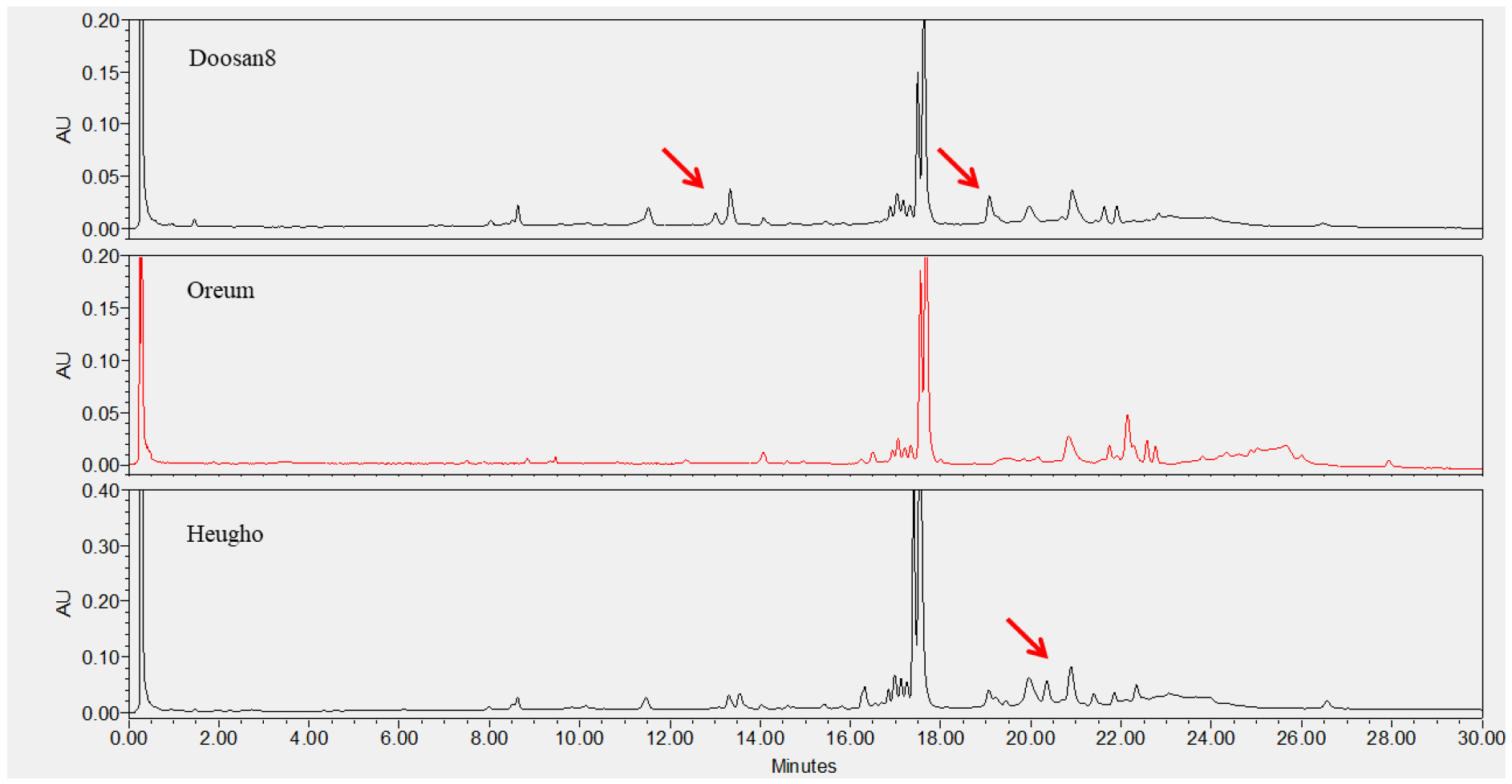
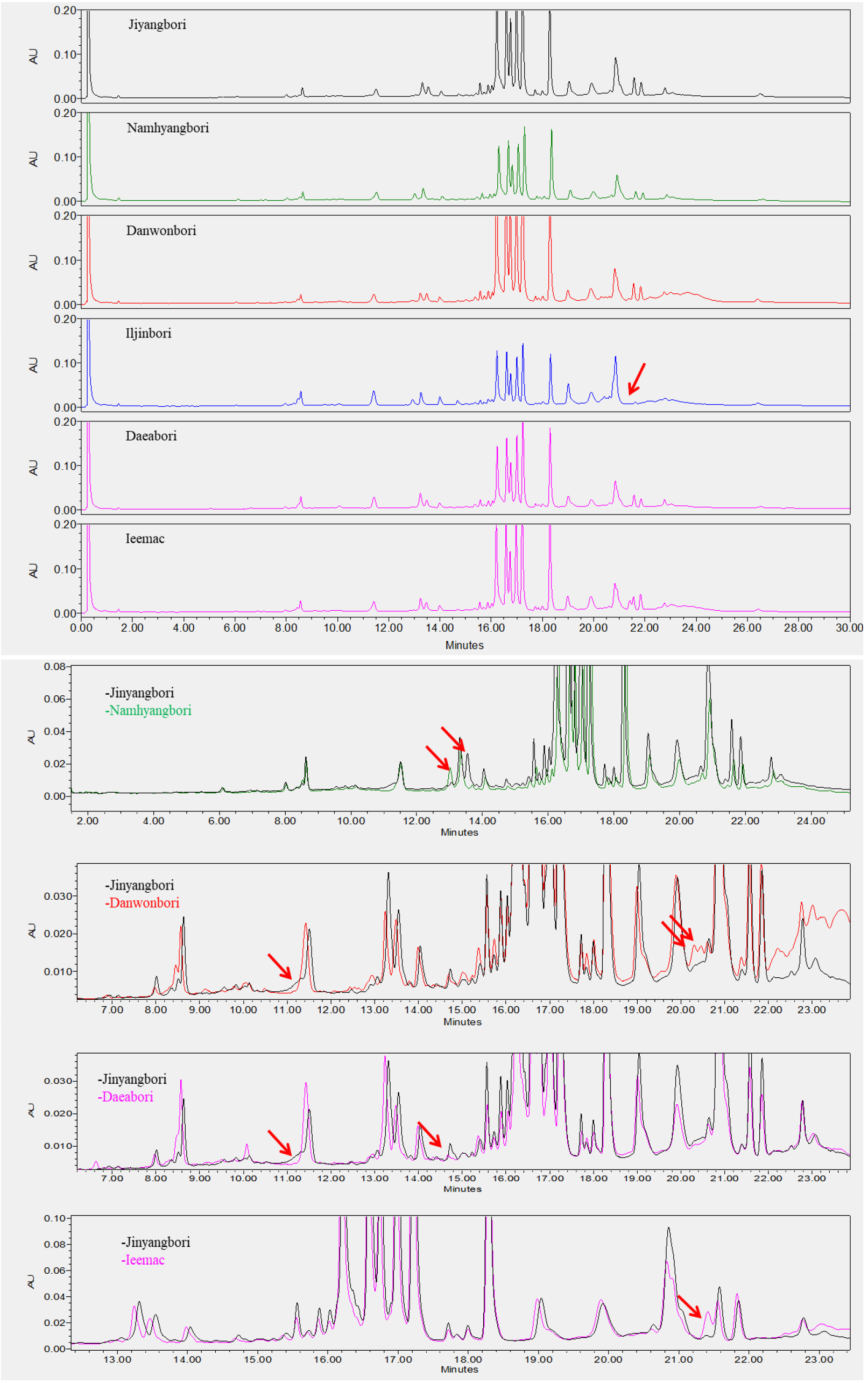
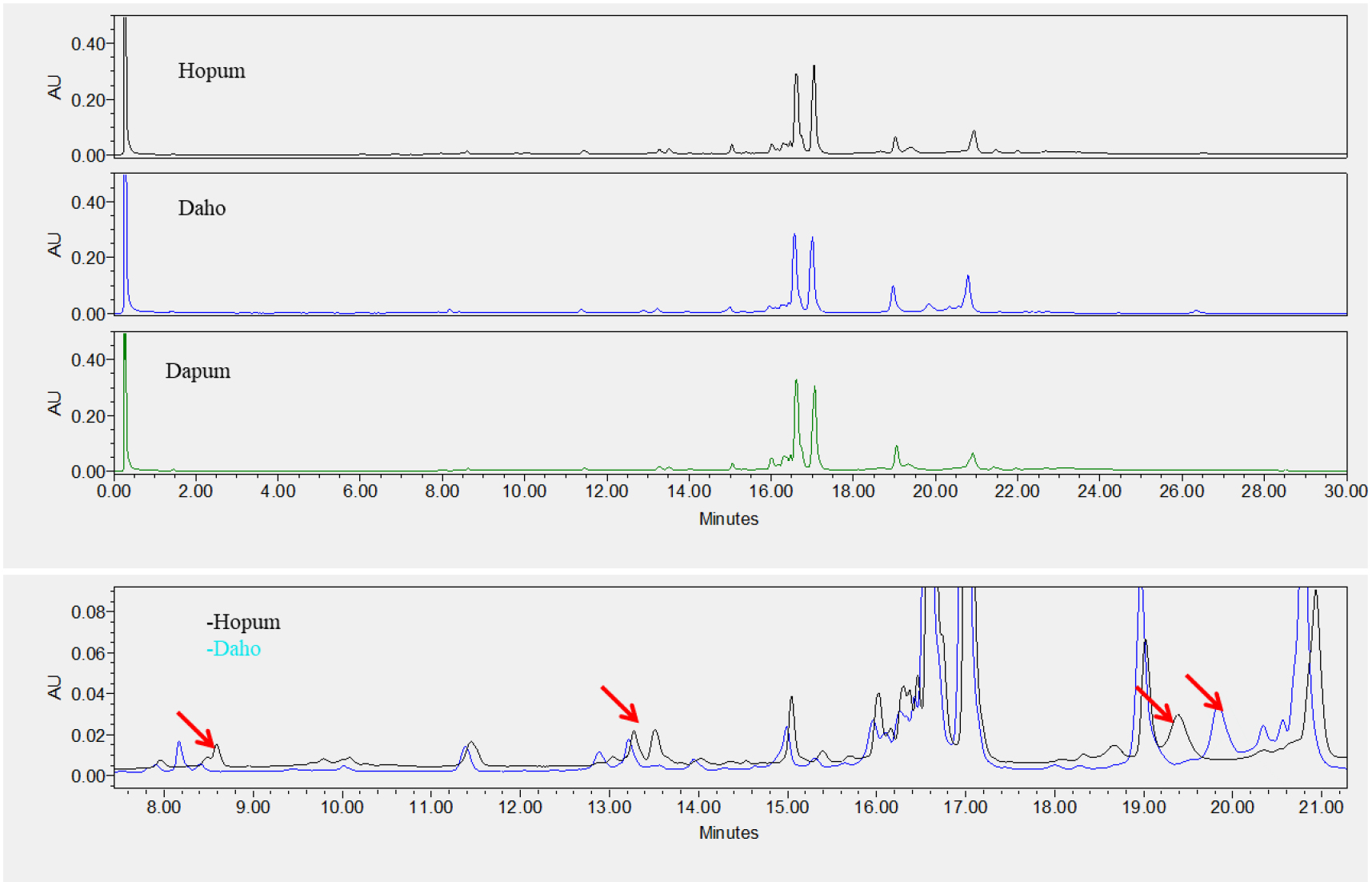
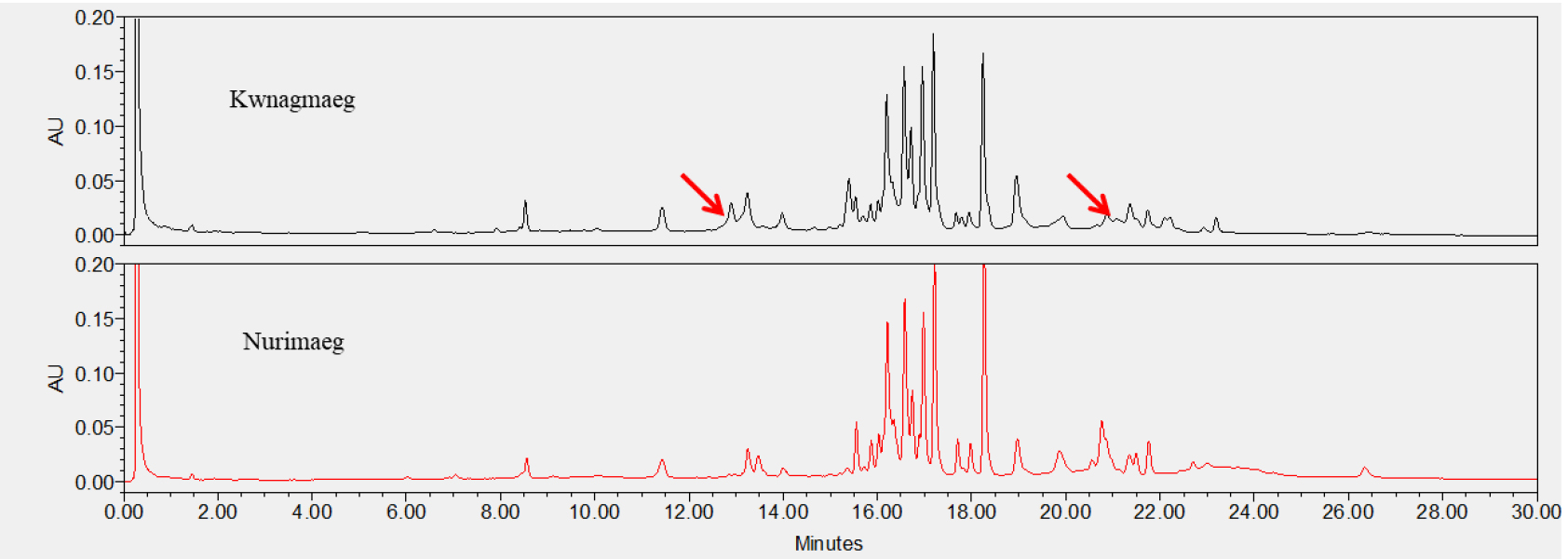
맥주보리 품종의 구분은 70% EtOH 추출물을 UPLC로 분석한 후, 호데인 구성 물질을 피크의 머무름 시간으로 비교하여 이루어졌다. 국내에서 육성된 26개 품종(Table 1)은 C-hordeins 구성(16분~18분)을 비교하여 피크의 유사성으로 VII그룹으로 크게 분류할 수 있었다. I그룹은 사천6호, 두산29호, 진광보리, 제주보리, 삼도보리, 대영보리, 다이안이 속해 있었으며 16.6분과 17.0분의 머무름 시간에서 주 피크 2개를 가지고 있음이 확인되었다(Fig. 6). I그룹 중 사천6호와 두산29호, 진광보리와 제주보리는 서로 피크 구성과 머무름 시간이 같아 C-hordeins의 분석만으로는 구분이 되지 않음을 알 수 있었다. 그러나 사천6호와 진광은 머무름 시간 12.8분~13.6분의 피크에서 차이를 보였으며, 사천6호와 삼도보리는 머무름 시간 8.5분과 12.8분에서 피크 차이를 보여 구분이 가능하였다. 사천6호와 다이안은 14.5분~15분 사이의 피크가 차이를 나타낸 것 외에는 크로마토그램이 유사하게 나타났다. II그룹은 머무름시간 17.5분과 17.6분에 주 피크 2개를 보인 두산8호, 오름, 흑호가 속했으며, 두산 8호와 오름은 머무름시간 13분~15분, 19분~20분 피크는 다른 양상을 보여 구분이 가능하였다(Fig. 7). III그룹은 진양보리, 남향보리, 단원보리, 일진보리, 대아보리, 이맥으로 16.2분, 16.6분, 17.7분, 17.0분, 17.2분의 4개의 주 피크가 분석됨이 확인되었다(Fig. 8). 진양보리와 남향보리는 13분~14분 사이의 피크가 달랐으며, 진양보리와 단원보리는 11분~12분, 20분~21분의 피크가 다르게 나타나 품종이 구분이 가능하였다. 진양보리와 대아보리는 11분~12분, 14.8분의 피크가 다르게 나타났다. IV그룹은 신호보리, 호진, 다진이 속하였으며, 16.6분, 16.7분, 17.0분에 3개의 주 피크가 존재하였고, 신호보리와 호진은 19.8분, 신호보리와 다진은 12.5분에서 13.5분의 피크가 다르게 분석되어 품종의 구분이 가능함을 알 수 있었다(Fig. 9). V그룹은 호품, 다호, 다품으로 16.7분과 17.2분에 2개의 주 피크가 확인되었다(Fig. 10). 호품과 다품의 크로마토그램이 일치하였는데, 다품은 호품과 GobDH96을 교배하여 육성한 품종(Yoon et al., 2020)으로 호품의 영향을 받아 C-hordeins의 구성이 같게 나타난 것으로 생각된다. 호품과 다호는 8분~9분, 13분~14분, 19.2분~20분 사이의 피크가 다르게 나타나 품종의 구분이 가능함을 알 수 있었다. VI그룹은 백호와 백록이 속하며 17.0분에 주 피크 1개를 가지고 있음이 확인되었는데(Fig. 11), 이들은 13.8분~14.2분, 19.8분의 피크가 달라 품종의 구분이 가능함을 알 수 있었다. VII그룹은 광맥과 누리맥이 속했으며 5개의 주 피크가 머무름시간 16.2분, 16.6분, 16.8분, 17.0분, 17.2분에 존재함이 확인되었다(Fig. 12). 광맥과 누리맥은 13분과 21분의 피크 구성이 달라 이들 또한 구분이 가능함을 알 수 있었다. Marchyol & Kruger (1985)는 캐나다산 22개의 보리 품종과 10개의 맥아를 RP-HPLC를 이용하여 구분하고자 컬럼의 길이와 충진물의 알킬기 길이가 다른 컬럼을 이용하여 비교하였다. 컬럼의 종류가 달랐을 때 분리능(resolution)의 차이는 없었지만, 분리인자(selectivity)는 약간의 차이가 있었다고 보고하였다. 호데인 단백질의 추출은 1% DTT가 함유된 50% 1-propanol, 분석은 Aquapore RP-300 (10 μm, C8) 컬럼을 이용한 105분 분석시간으로 2품종을 제외하고 모든 품종의 구분이 가능하였다고 보고 하였다. Šalplachta & Bobálová (2009)는 MALDI-TOF 질량분석을 이용한 보리의 호데인 단백질 분석으로 맥주보리 품종을 구분하고자 하였으며, 알부민과 글로블린 제거를 위한 5% NaCl 처리는 EtOH와 propanol을 이용한 호데인 추출에는 영향을 주지 않았다고 보고하였다. 추출온도(RT, 60°C)를 달리했을 때 호데인은, 고온일 경우 추출되는 단백질 양은 많으나 실온 추출과 비교했을 때 단백질 패턴에는 영향이 없었다고 하였다. 따라서 60% EtOH를 이용한 실온 추출로 맥주보리 13품종을 호데인 분석을 통해 확인할 수 있었다고 보고 하였다.
본 연구에서는 맥주보리의 70% 알코올 추출에 의한 C-hordeins의 UPLC 분석으로 사천6호와 두산29호, 진광보리와 제주보리, 호품과 다품을 제외한 26개 육성 품종 중 20개의 품종을 구분할 수 있었다.
적 요
맥주보리 품종의 C-hordeins 분석을 위해 70% EtOH와 55% IPA가 추출용매로 이용되었으며, B-hordeins의 추출은 알코올성 용매에 1% DTT를 추가하여 수행되었다. D-hordeins은 보리 호데인 단백질 중 가장 분자량이 큰 단백질로 약산 혹은 약염기에서 용해가 이루어진다고 알려져 있으며, 본 연구에서는 pH 8.0의 약염기 용매가 추출용매로 이용되었다. 알코올성 용매 종류에 따른 C-hordeins의 구성과 양의 차이는 확인되지 않았으며 1% DTT가 첨가된 알코올성 용매에 B-hordeins과 C-hordeins이 모두 추출됨이 확인되었다. D-hordeins 추출 조건에서는 B-, C-, D-hordeins이 모두 분석되었지만 B-hordeins의 머무름 시간은 1% DTT가 함유된 알코올 추출과 차이가 있었다.
국내 육성된 맥주보리 26품종들의 C-hordeins 분석을 통해 머무름 시간 16분에서 18분 사이의 피크 유사성을 가지고 7개의 그룹으로 분류할 수 있었다. 또한 맥주보리 육성품종 중 사천6호와 두산29호, 진광보리와 제주보리, 호품과 다품보리를 제외한 20개 품종들은 마이너 피크들의 분석을 통해 품종의 구분이 가능하였다.