서 론
재료 및 방법
식물재료 및 재배방법
안토시아닌 함량 및 성분 측정
RNA 분리 및 RT-PCR
지방산 조성 분석
Phytosterol 조성 분석
통계분석
결과 및 고찰
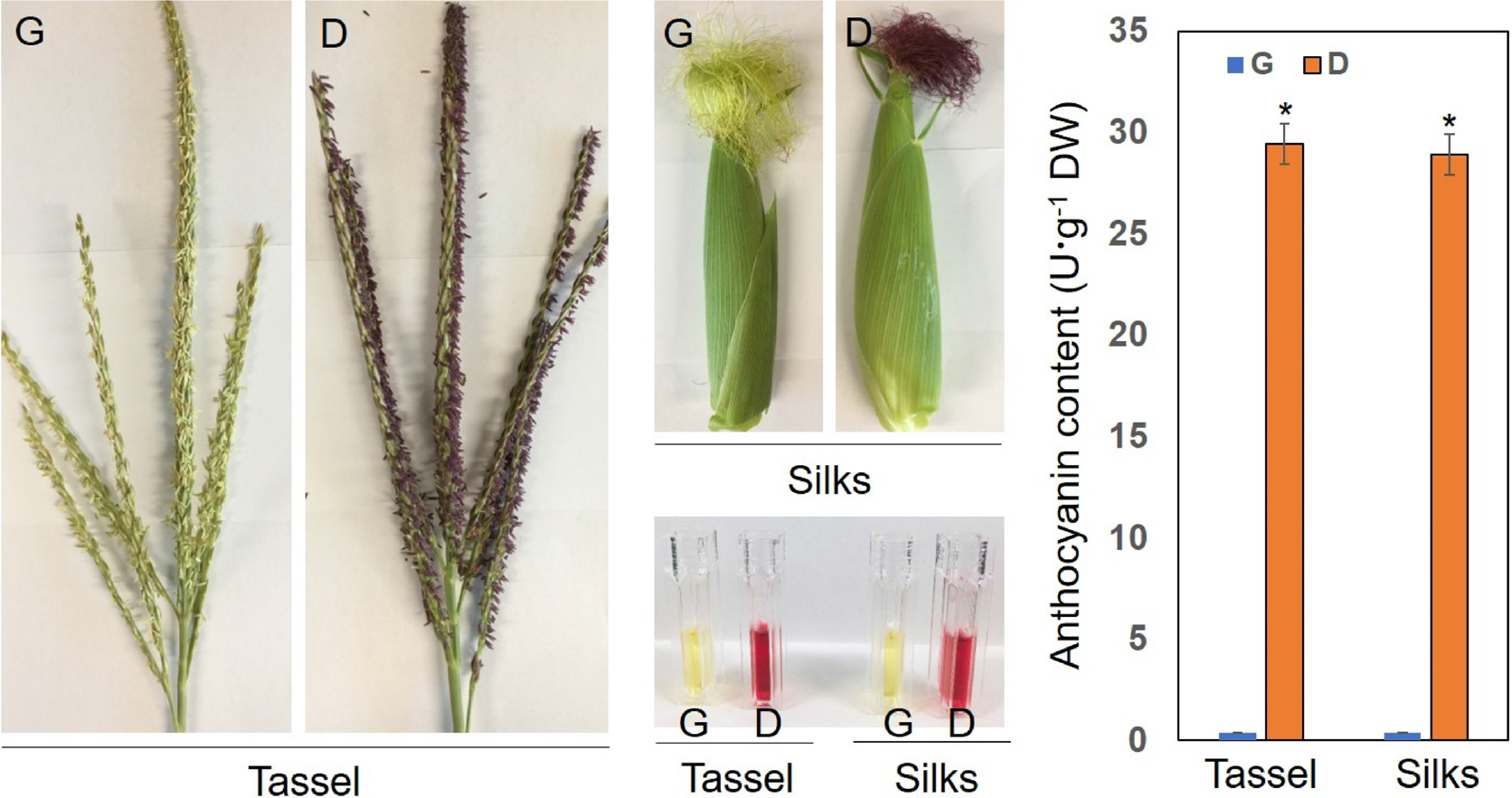
광평옥의 수이삭과 수염은 안토시아닌이 형성되지 않고, 다청옥은 안토시아닌이 형성되었다.
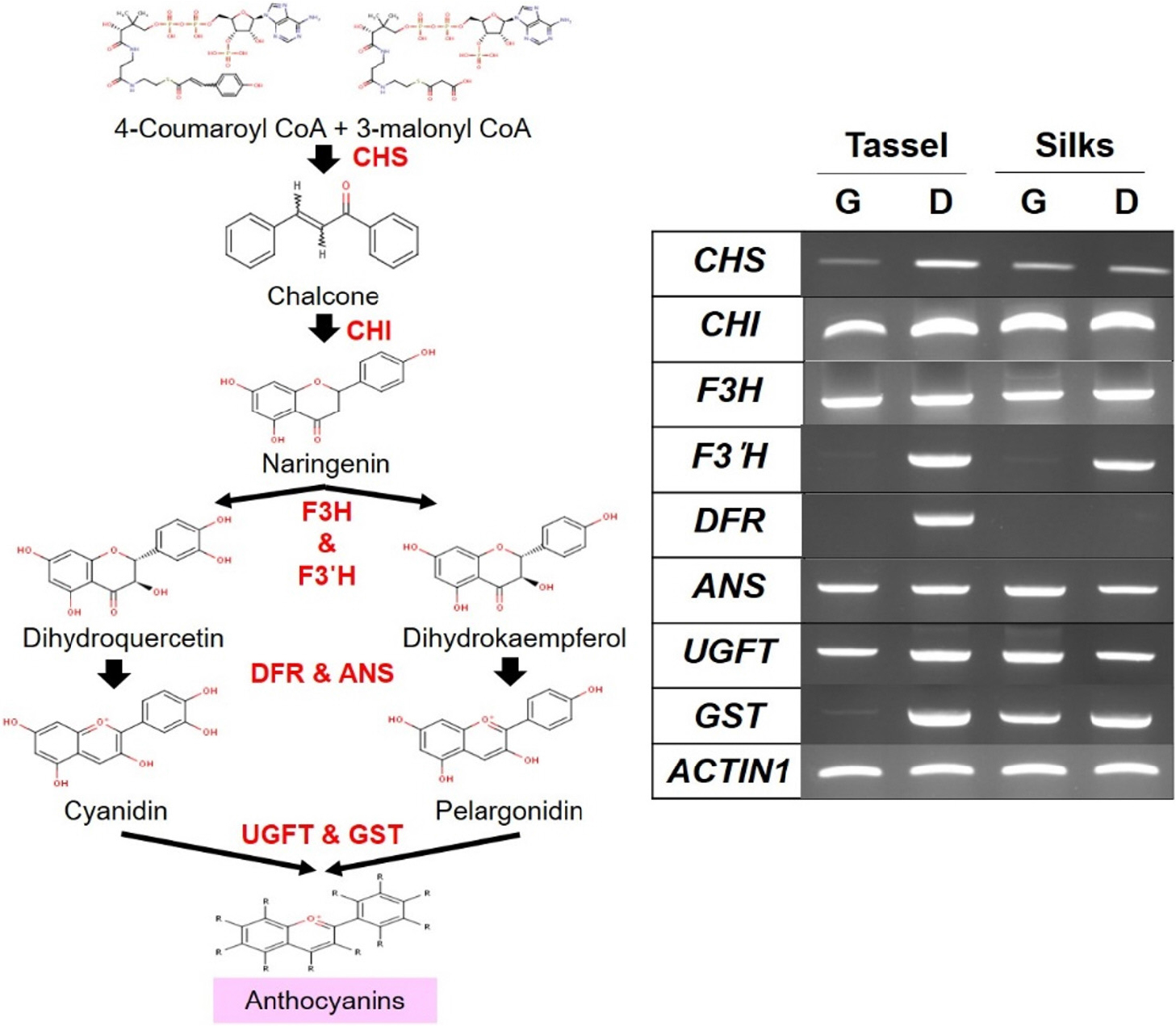
안토시아닌 생합성 유전자의 발현은 광평옥의 수이삭과 수염에서 감소하고, 다청옥에서 증가하였다.
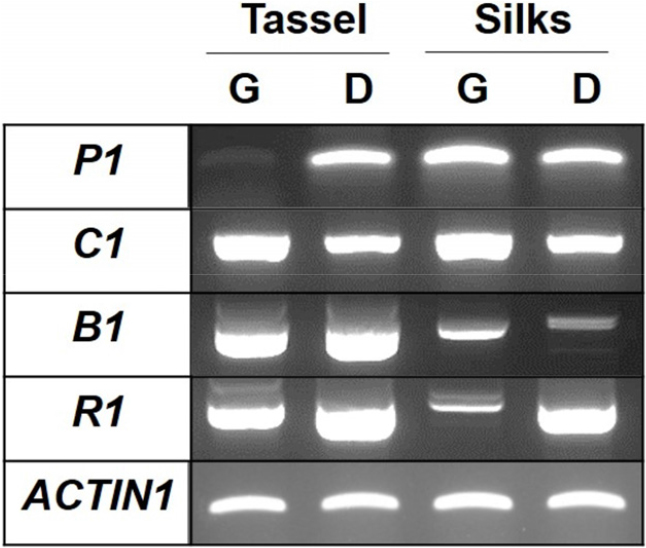
안토시아닌 생합성 조절인자의 발현이 광평옥에서 감소하고, 다청옥에서 증가하였다.
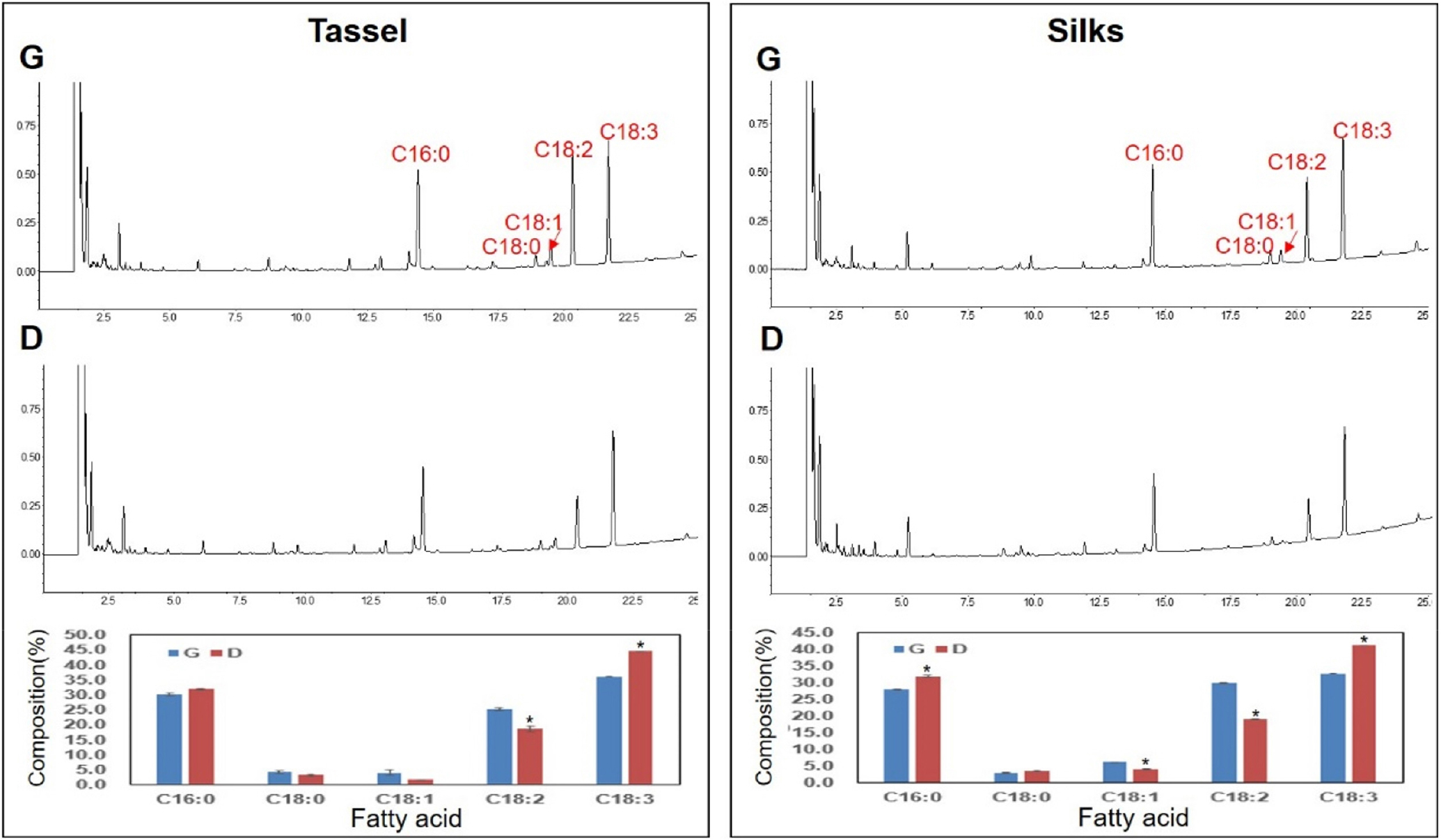
광평옥 수이삭과 수염에서 지방산 함량이 다청옥에 비해 증가하였다.
광평옥과 다청옥의 수이삭과 수염에서 phytosterol 함량의 차이가 없었다.
적 요
서 론
옥수수(maize, Zea mays L.)는 3대 식량 작물 중 하나이며, 줄기부터 수술까지 모든 부위가 식품, 산업 소재 및 제약 원료 등으로 폭넓게 사용되고 있다. 최근 식물에 존재하는 기능성 물질에 관심이 높아지면서 옥수수의 안토시아닌 생합성 유전자 발현 및 조절에 대한 연구도 많이 진행되어져 왔다(Quattrocchio et al., 1993; Sharma et al., 2012; Riaz et al., 2019). 또한 안토시아닌 성분의 유용한 기능을 확인하기 위하여 동물 시험도 수행되었다(Petroni et al., 2014). 이러한 안토시아닌은 옥수수의 수이삭과 수염에 존재 유·무에 따라 품종을 구분하는 특성으로 많이 활용되고 있지만, 안토시아닌이 형성되지 않는 품종과 형성되는 품종 간의 안토시아닌 생합성 유전자들의 발현 비교 분석은 거의 진행되지 않았다.
안토시아닌은 식물에 유일하게 존재하는 보라색 색소이며 항산화 효과를 가지고 있다고 알려져 있다. 또한 사람의 심혈관 질환, 암, 비만과 같은 다양한 질병을 예방할 수 있는 물질로 각광을 받고 있다(Petroni et al., 2014). 이러한 안토시아닌은 다양한 식물이 가지고 있으며, 그 중 옥수수에 다량 존재하는 안토시아닌은 bHLH (basic helix-loop-helix) 모티프와 myb 도메인을 가지고 있는 전사조절인자에 의해 생합성이 조절된다고 보고되었다(Lesnick & Chandler, 1998). 예를 들면 bHLH 계열의 R1 (red1)과 B1 (booster1), MYB 계열의 P1 (pericarp color1)과 PL1 (purple plant1) 전사조절인자들은 chalcone synthase (CHS), chalcone isomerase (CHI)와 flavonoid 3’-hydroxylase (DFR) 등 안토시아닌 생합성 관련 유전자들의 발현을 조절한다고 알려져 있다(Sharma et al., 2012; Riaz et al., 2019). 또한 옥수수의 leaf colour (Lc) 조절 유전자가 사과에 과다 발현 시켰을 때, CHS, CHI와 DFR 등과 같은 대부분의 안토시아닌 생합성 관련 유전자들의 mRNA 발현이 7배 이상 증가되는 것을 관찰하였다(Li et al., 2007).
국내에서는 옥수수의 안토시아닌 존재 여부를 품종 특성 조사 기준으로 사용하고는 있었지만, 기능성 측면에서는 전혀 활용하지 않았다. 그러나 최근에 생리활성물질로 안토시아닌의 중요성이 커지면서 옥수수에서 cyanidin 3-glucoside 등과 같은 다양한 안토시아닌 성분을 분리하고, 자색 옥수수 생리 특성에 대한 연구가 진행되었다(Kim et al., 2000; Lee et al., 2016). 또한, 옥수수 수염에서 추출한 안토시아닌 성분이 항산화 효과를 가지고 있으며, 옥수수 종피에 존재하는 R 유전자가 안토시아닌 합성을 조절한다고 보고하였다(Ku et al., 2009; Kim H., 2010). 국내에서는 안토시아닌 성분에 대한 연구는 활발히 진행되고 있지만, 안토시아닌 생합성에 관련된 기초연구는 다소 미흡한 실정이다. 따라서 본 연구는 광평옥과 다청옥 품종의 수이삭과 수염을 대상으로 안토시아닌 생합성 관련 분자생물학적 및 이화학적 특성을 검토하여 향후 기능성 옥수수 개발에 필요한 기초자료로 활용하고자 하였다.
재료 및 방법
식물재료 및 재배방법
본 실험은 농촌진흥청 국립식량과학원 중부작물부 작물연구동(수원시 권선구) 비가림 비닐하우스에서 수이삭과 수염에 안토시아닌이 형성되지 않는 광평옥과 안토시아닌이 형성되는 다청옥 옥수수 품종을 사용하여 연구를 수행하였다(Moon et al., 2001; Son et al., 2018). 옥수수 종자를 50공 플라스틱 육묘 상자에 4월 20일에 파종하여 10일된 옥수수를 비닐하우스에 있는 포장에 20개체씩 재식 거리 60 cm × 25 cm로 이식하였다. 질소-인산-칼리 비료는 농촌진흥청 표준 시비량(17.4-3.0-6.9 kg/10a)에 따라 시용하였다. 옥수수의 수이삭과 수염은 파종 후 80일 이후에 채취하였고, 수염은 수정이 되지 않도록 비닐로 덮어주었다.
안토시아닌 함량 및 성분 측정
광평옥과 다청옥의 수이삭과 수염을 막대사발로 분쇄한 후, 동결건조하여 시료를 준비하였고, 건조분말시료 0.1 g에 1% citric acid가 함유된 70% 메탄올을 2 ml씩 첨가하고, 12시간동안 상온에서 반응하여 1 ml씩 추출하였다. 추출액은 Spectrophotometer로 530 nm와 657 nm의 파장에서 흡광도를 측정하였다. 측정한 값은 A530-(1/4*A657)/dry weight 계산식에 대입하여 안토시아닌 총 함량 unit값을 구하였다(Zhang et al., 2018). 안토시아닌 성분은 건조분말시료 0.1 g에 0.1N HCl이 함유된 80% 메탄올 4 mL씩 첨가하여 4°C에서 24시간 배양시킨 후 10,000 rpm에서 10분 원심분리 하였다. 추출한 상등액은 0.45 µm membrane filter에 통과시켜 HPLC 분석을 수행하였다. 컬럼은 YMC-Pack ODS-AM을 사용하였고, 5% HCOOH가 함유된 증류수와 acetonitrile을 이동상으로 사용하여 유속 0.7 mL/min으로 40분 동안 분석하였다. 표준물질로 cyanidin chloride, myrtillin chloride, pelagonin chloride pelargonidin chloride, peonidin chloride 등을 사용하여 정량곡선을 작성하고 안토시아닌 색소 함량을 정량하였다(Welch et al., 2008). 이 실험들은 모두 3반복 수행하였다.
RNA 분리 및 RT-PCR
광평옥과 다청옥의 수이삭과 수염에서 Plant RNA Extraction Kit (Qiagen)을 이용하여 총 RNA를 추출하였고, GoScriptTM Reverse Transcription System (Promega) 사용하여 cDNA를 합성하였다. RT- PCR 조건은 50 ug의 cDNA을 주형으로 사용하여 94°C 5분 반응한 후, 94°C 30초, 58°C 30초, 72°C 40초로 35 cycle PCR을 수행하였다. 안토시아닌 생합성에 관련된 유전자 특이적 primers는 200~500 bp 크기로 증폭되게 제작하였다(Sharma et al., 2011; Liu et al., 2018). DNA 밴드는 1.2% agarose gel에서 100V 전압으로 15분 전기영동하여 분리하여 확인하였다. RT-PCR에 사용된 각 프라이머 정보는 Table 1에 표기하였고, 각 샘플들의 cDNA 농도를 표준화하기 위하여 옥수수 ACTIN1 유전자를 사용하였다.
Table 1.
Primers of anthocyanin biosynthesis-related genes used in this study.
지방산 조성 분석
분쇄한 후 동결 건조한 옥수수 수이삭과 수염 분말 20 mg에 methanol : heptane : benzene : 2,2-dimethoxypropane : H2SO4가 37:36:20:5:2 (v/v)로 혼합된 용액 2 ml을 첨가하고 80°C에서 1시간 동안 가열하였다. 상온에서 냉각한 후, 상등액을 추출하여 GC-FID (Gas Chromatography-Flame Ionization Detector, Shimadzu Corporation inc., Japan)와 HP-Innowax capillary column (0.25 μm × 30 m, Agilent Technologies Inc., USA)를 사용하여 지방산 조성을 분석하였다. 분석 조건은 Oven 온도를 150°C에 200°C까지 분당 2.5°C씩, 200°C에서 240°C까지 3°C씩 상승시킨 후, 240°C에서 10분 반응하였다. Injector와 detector 온도는 250°C로 설정하였고, carrier gas는 N2를 사용하였다(Kim et al., 2018).
Phytosterol 조성 분석
분쇄한 후 동결 건조한 옥수수 수이삭과 수염 분말 100 mg에 메탄올에 10% KOH 용해시킨 용액 5 ml을 첨가하여 60°C에서 90분 동안 saponification 시켰다. 상온에서 냉각 시킨 후, 2 ml씩 3차멸균수와 n-hexane을 첨가하여 반응시킨 후, 상등액을 추출하였다. 추출한 상등액은 3M paper로 필터링하여 수분을 제거하고, N2 가스로 건조시킨 후, 100 ul씩 BSA[N, O-bis(trimethylsilyl)acetamise]와 pyridine을 첨가하여 60°C에서 30분 반응하였다. BSA와 pyridine에 의해 TMS 유도체화된 샘플은 N2 가스로 건조시킨 후, n-hexane로 녹여 GC-MS (Gas Chromatography-Mass Spectrometry, Shimadzu Corporation inc., Japan)로 분석하였다. 컬럼은 HP-5ms capillary column (30 m × 0.25 mm, 0.25 μm, Agilent Technologies Inc., USA)을 사용하였으며, injector의 온도 260°C, FID detector 310°C로 설정하고, chamber의 온도를 150°C에서 320°C까지 분당 10°C씩 상승시키면서 phytosterol의 조성을 3반복으로 분석하였다(Upadhyay & Dixit, 2015; Kim et al., 2018).
통계분석
모든 실험 데이터는 평균 ± 표준편차(SD)로 표시하였고, 통계 분석은 SPSS 통계 패키지(SPSS Institute, USA) 프로그램을 사용하였다. 통계적 검증은 t-test를 사용하여 p값이 0.05미만인 경우를 유의한 차이가 있는 것으로 판단하였으며, 모든 실험은 3반복을 수행하였다.
결과 및 고찰
광평옥의 수이삭과 수염은 안토시아닌이 형성되지 않고, 다청옥은 안토시아닌이 형성되었다.
국내 사료용옥수수로 사용되는 광평옥과 다청옥의 수이삭과 수염을 관찰한 결과, 표현형에는 큰 차이를 보이지 않았다. 그러나 광평옥은 안토시아닌이 형성되지 않았고, 다청옥은 안토시아닌이 형성되는 것을 관찰하였다(Fig. 1). 관찰한 결과를 수치로 확인하기 위하여 각 품종의 수이삭과 수염에서 안토시아닌을 추출하여 측정한 결과, 안토시아닌 총 함량이 광평옥보다 다청옥에서 30배 이상 존재하는 것을 확인하였다(Fig. 1).
또한, 안토시아닌 성분 분석을 통해 cyaniding-3-O-glucoside chloride (C-3-G), pelargonidin-3-O-glucoside chloride (pg- 3-G), malvidin-3-O-glucoside chloride (M-3-G) 성분이 광평옥 수이삭과 수염에서는 거의 측정되지 않고, 다청옥 수이삭과 수염에서만 측정이 되는 것을 확인하였다(Table 2). 이러한 결과는 안토시아닌을 가지고 있는 품종과 없는 품종에서 안토시아닌 형성에 차이가 있을 수 있다는 사실을 알려주었다(Halbwirth et al., 2003; Duangpapeng et al., 2019).
Table 2.
Anthocyanin composition of tassel and silks in Gwangpyeongok and Dacheongok.
| Anthocyanin content (µg/g of dry weight) | ||||
| C-3-G | Pg-3-G | M-3-G | ||
| Gwangpyeongok | Tassel | N.D.1) | N.D. | N.D. |
| Silks | 29.8 ± 0.42) | N.D. | N.D. | |
| Dacheongok | Tassel | 139.2 ± 3.4a) | 30.8 ± 0.7a) | 293.9 ± 4.9a) |
| Silks | 629.9 ± 12.6b) | 84.3 ± 2.4b) | 1103.9 ± 2.9b) | |
안토시아닌 생합성 유전자의 발현은 광평옥의 수이삭과 수염에서 감소하고, 다청옥에서 증가하였다.
옥수수의 안토시아닌 생합성 관련 유전자를 선발하고 발현을 확인하기 위하여 기존에 보고된 논문에서 안토시아닌 생합성 유전자들과 그 유전자에 대한 특이적 프라이머 정보를 참고하였다(Sharma et al., 2011; Liu et al., 2018). 옥수수에서 안토시아닌 생합성은 chalcone synthase (CHS), chalcone isomerase (CHI), flavanone 3-hydroxylase (F3H), flavanone 3’-hydroxylase (F3’H), dihydroflavonol 4-reductase (DFR), anthocyanidin synthase (ANS), UDP-Glu-flavonoid 3-O-glucosyl transferase (UFGT), glutathione-S-transferase (GST) 등 8개의 유전자가 직접적으로 관여한다고 보고되었다(Liu et al., 2018). 광평옥과 다청옥의 수이삭과 수염에서 안토시아닌 생합성 유전자 발현을 확인하기 위하여, 8개 유전자의 특이적 프라이머를 제작하여 광평옥과 다청옥의 수이삭과 수염의 RNA을 가지고 RT-PCR을 수행하였다. 그 결과, 광평옥의 수이삭에서 F3’H, DFR, GST 유전자가 발현이 감소하였고, 수염에서는 F3’H와 DFR 유전자가 발현이 감소하였다(Fig. 2). 반대로 다청옥에서는 수염에서 DFR 유전자만 발현이 감소되었고, 나머지 유전자들은 정상적으로 발현되었다(Fig. 2). 이러한 결과는 안토시아닌 생합성 유전자의 발현이 감소하면, 안토시아닌이 정상적으로 형성되지 않는 결과와 일치되는 것으로 확인되었다(Sharma et al., 2011).
안토시아닌 생합성 조절인자의 발현이 광평옥에서 감소하고, 다청옥에서 증가하였다.
옥수수에서 안토시아닌 생합성 유전자들의 발현은 다양한 전사조절인자에 의해 조절된다고 보고되었다(Sharma et al., 2011; Sharma et al., 2012; Riaz et al., 2019). 광평옥의 수이삭과 수염에서 F3’H 유전자의 발현이 다청옥에 비해 감소하는 것을 이전 결과에서 확인하였기 때문에, F3’H 유전자의 발현을 조절하는 P1 전사조절인자의 발현을 확인하였다. 그 결과, 광평옥의 수이삭에서 pericarp color1 (P1) 전사조절인자의 발현이 감소한 것을 관찰하였지만, 수염에서는 차이를 보이지 않았다(Fig. 3). 수염에서 안토시아닌 생합성을 조절하는 전사조절인자를 찾기 위하여, 다른 전사조절인자들의 발현을 조사하였다. Colorless1 (C1), booster (B1), red1 (R1) 전사조절인자의 발현을 수염에서 확인한 결과, R1 전사조절인자의 발현이 광평옥의 수염에서 다청옥에 비해 감소되었고, B1 전사조절인자의 발현은 다청옥의 수염에서 광평옥에 비해 감소되는 것을 관찰하였다(Fig. 3). 이러한 결과를 통해서 옥수수 수이삭의 안토시아닌 합성은 F3’H 유전자의 발현을 조절하는 P1에 의해서 조절이 되고, 수염의 안토시아닌 합성은 DFR 유전자의 발현을 조절하는 R1 전사조절인자에 의해서 조절된다는 사실을 확인하였다(Tian et al., 2017). 그러나 다청옥의 수염에서 DFR 유전자의 발현이 없었는데 R1 전사조절인자의 발현이 높은 것은 향후 전사체 분석을 통한 세부적인 분석이 필요한 것으로 판단되었다.
광평옥 수이삭과 수염에서 지방산 함량이 다청옥에 비해 증가하였다.
광평옥과 다청옥의 수이삭과 수염에서 안토시아닌 함량을 분석한 결과(Fig. 1), 광평옥의 수이삭과 수염에서 안토시아닌 함량이 감소하였고, 이러한 성분 변화가 전구 물질로 사용되는 지방산 함량에 어떠한 영향을 주었는지 확인하였다. 광평옥의 수이삭과 수염에서 다청옥에 비해 각각 linoleic acid (C18:2)가 6.6%, 10.9% 감소하고, linolenic acid (18:3)는 8.5%, 8.5% 증가하였다. 또한, 광평옥의 수염에서는 palmitic acid (C16:0)가 4.1% 증가하고, oleic acid (C18:1)는 다청옥에 비해 2.1% 감소하였다. 그러나 stearic acid (18:0)는 수이삭과 수염에서 성분 변화가 전혀 없었다(Fig. 4).
또한, 광평옥의 수이삭과 수염의 전체 지방산 함량은 광평옥에 비해 각각 10.3%, 30.4% 증가하였고, 각 지방산 성분과 함량 분석은 유사한 결과를 보여주었다(Table 3). 이러한 결과는 옥수수 수이삭과 수염에서 안토시아닌 생합성의 억제가 전구 물질인 지방산의 함량 증가에 영향을 미칠 수 있다는 것을 알려주었다(Zuk et al., 2016).
Table 3.
Fatty acid composition of tassel and silks in Gwangpyeongok and Dacheongok.
| Fatty acid content (µg/mg of dry weight) | |||||||
| 16:0 | 18:0 | 18:1 | 18:2 | 18:3 | Total | ||
| Gwangpyeongok | Tassel | 6.3 ± 0.21),a) | 0.8 ± 0.1a) | 0.8 ± 0.1a) | 5.4 ± 0.2a) | 7.8 ± 0.3a) |
21.1 ± 0.8a) (10.3% ↑) |
| Silks | 7.5 ± 0.2a) | 0.8 ± 0.1a) | 1.7 ± 0.1a) | 8.0 ± 0.2a) | 8.8 ± 0.2b) |
26.8 ± 0.6b) (30.4% ↑) | |
| Dacheongok | Tassel | 6.0 ± 0.1a) | 0.6 ± 0.1a) | 0.3 ± 0.1a) | 3.5 ± 0.2a) | 8.4 ± 0.1a) | 18.9 ± 0.3a) |
| Silks | 6.4 ± 0.2b) | 0.7 ± 0.1a) | 0.8 ± 0.1a) | 3.8 ± 0.1b) | 8.3 ± 0.2b) | 20.0 ± 0.6b) | |
광평옥과 다청옥의 수이삭과 수염에서 phytosterol 함량의 차이가 없었다.
옥수수에서 지방산 함량의 변화가 안토시아닌과 유사한 링 구조를 가지고 있는 phytosterol에도 어떠한 영향을 주는지 확인하기 위하여, 광평옥과 다청옥의 수이삭과 수염을 이용하여 phytosterol 분석을 수행하였다. 분석한 결과, phytosterol의 주 성분인 campesterol, stigmasterol, ß-sitosterol의 함량이 광평옥과 다청옥의 수이삭과 수염에서 큰 차이를 보이지 않았다(Fig. 5). 그러나 GC-MS 분석을 통해 다청옥에서 확인되지 않는 새로운 peak가 광평옥에서 발견되었지만, 그 물질에 대한 정확한 정보는 확인할 수가 없었다. 이러한 결과는 향후 대사체 분석을 통한 세부적인 분석이 더 필요한 것으로 판단되었다.
적 요
본 실험은 광평옥과 다청옥 품종의 수이삭과 수염을 대상으로 안토시아닌 생합성 관련 분자생물학적 및 이화학적 특성을 검토하여 향후 기능성 옥수수 개발에 필요한 기초자료로 활용하고자 수행되었다.
1. 광평옥에서는 수이삭과 수염에서 모두 안토시아닌이 형성되지 않은 반면, 다청옥에서는 모두 형성되었다. 전체 안토시아닌 함량은 수이삭과 수염에서 모두 다청옥이 광평옥에 비해 30배 정도 높았다. 또한, 안토시아닌 성분은 다청옥의 수이삭에서 C-3-G만 측정되었고, 수염에서는 각각 C-3-G는 45.2배, Pg-3-G는 27.3배, M-3-G는 37.6배 광평옥에 비해 더 검출되었다.
2. 광평옥의 수이삭에서 F3’H, DFR, GST 유전자가 발현이 감소하였고, 수염에서는 F3’H와 DFR 유전자가 발현이 감소하였다. 반대로 다청옥에서는 수염에서 DFR 유전자만 발현이 감소되었고, 나머지 유전자들은 정상적으로 발현되었다. 또한 안토시아닌 생합성 유전자들의 발현을 조절하는 전사조절인자는 광평옥 수이삭에서는 P1이 수염에서는 R1이 관여한다는 사실을 확인하였다.
3. 광평옥의 수이삭과 수염에서 다청옥에 비해 각각 linoleic acid (C18:2)가 6.6%, 10.9% 감소하고, linolenic acid (18:3)는 8.5%, 8.5% 증가하였다. 또한, 광평옥의 수염에서는 palmitic acid (C16:0)가 4.1% 증가하고, oleic acid (C18:1)는 다청옥에 비해 2.1% 감소하였다. 그러나 stearic acid (18:0)는 수이삭과 수염에서 성분 변화가 전혀 없었다. 그리고 광평옥의 수이삭과 수염의 전체 지방산 함량은 광평옥에 비해 각각 10.3%, 30.4% 증가하였고, 각 지방산 성분과 함량 분석은 유사한 결과를 보여주었다. 그러나 phytosterol 성분 분석에서는 유의미한 결과를 확인할 수가 없었다.