서 론
재료 및 방법
실험재료 및 고구마 수량 평가
베타카로틴함량
안토시아닌함량
총폴리페놀 함량
플라보노이드함량
통계분석
결과 및 고찰
고구마 품종별 재식 간격 및 재배 기간에 따른 괴근 수량 비교
재식 간격 및 재배 기간에 따른 베타카로틴(주황미)과 안토시아닌(신자미) 함량 비교
고구마 품종별 재식 간격 및 재배 기간에 따른 폴리페놀 함량 비교
고구마 품종별 재식 간격 및 재배 기간에 따른 플라보노이드 함량 비교
적 요
서 론
고구마(Ipomoea batatas L.)는 아열대 작물로서 일반적으로 일년생 작물로 재배된다. 재배방법과 품종 등에 따라 재배기간은 약 12주에서 35주 정도 소요된다(Hahn & Hozyo, 1984; Huett et al., 1976; Nair et al., 1986). 고구마는 불합리한 환경에서도 잘 적응하여 재배가 용이하고 면적당 생산량이 뛰어나며 전분함량이 높아 쌀, 보리 등과 같은 주요 곡류와 함께 식량자원으로 재배되고 있다(Kim et al., 1995; Jung et al., 1998; Park et al., 2006). 서구화된 식생활로 암, 고혈압, 당뇨병 등 성인병이 급증하게 되면서 건강식품에 대한 관심이 커지게 되었다. 최근 고구마는 영양적 가치와 기능성에 대한 관심이 높아지면서 수요가 증가되었고 고구마의 고품질화, 안정생산 및 공급 등이 요구되기 시작하였다. 고구마에서 안토시아닌, 폴리페놀, 베타카로틴, 플라보노이드 등 다양한 유용성분들이 건강기능식품의 소재로서 관심을 받고 있으며 다양한 연구가 이루어지고 있다(Yoshimoto et al., 2001; Lee et al., 2012; Kim et al., 2012). 주황색고구마는 비타민 A의 전구체인 카로틴의 풍부한 천연 공급원이다. 비타민 A 결핍은 면역 체계를 손상시키고 영향을 받은 어린이는 호흡기 및 설사 질환, 홍역 및 말라리아와 같은 일반적인 아동기 감염에 대한 저항력이 낮다. 주황색 고구마를 섭취하면 어린이의 비타민 A 상태가 개선되는 것으로 나타났다(van Jaarsveld et al., 2005).
한편, 자색고구마는 안토시아닌 함량이 높아 식품의 천연색소로 이용될 뿐만 아니라(Yoshimoto, 2001) 화장품분야에서도 가치를 높게 평가 받고 있다. 또한 안토시아닌은 항당뇨제, 항암제, 항염증제, 항균제 및 항비만 등 항산화활성과 같은 생리활성(Suda et al., 1999; Steed & Truong 2008) 측면에서도 효과가 보고되었다(Shin & Lee, 2019). 고구마의 안토시아닌 색소는 페오니딘(peonidin)의 기본구조에 페루르산(ferulic acid)과 카페인산(catteic acid)이 디아실레이션화된 구조를 가지고 있어 다른 안토시아닌 색소원에 비해 안정성이 높아 천연색소로 많이 이용되고 있다(Kim et al., 1996; Lee et al., 1996, 1997, 2000; Lee et al., 2000; Rhim & Lee, 2002).
이처럼 고구마 괴근은 베타카로틴이나 안토시안닌 같은 유용성분을 함유하고 있어 건강기능식품 등 다양한 식품가공소재로 이용되고 있다. 이러한 유용성분을 최대한 생산하기 위한 최적 재배환경 조건 확립에 대한 연구가 필요하다. Laurie et al. (2012)은 관수량과 시비량에 따른 고구마 괴근의 베타카로틴 함량 변화에 관한 연구를 수행하였다. 또한 최근 연구에서 고구마 잎자루 품종별 재배기간 및 마디별 경엽의 유용성분 함량과 항산화 활성을 분석하여 최적 재배기간을 구명하였다(Park et al., 2014). 하지만 고구마 괴근에서 재식간격 및 재배기간에 따라 괴근 수량과 유용성분 함량에 미치는 영향에 대한 연구는 부족한 실정이다. 우리나라의 전형적인 고구마 재배는 4월 중순에 묘를 삽식하여 8~9월에 수확하는 조기재배, 5월 중순에 묘를 삽식하여 9~10월에 수확하는 보통기 재배와 6월 중하순에 삽식 하여 10월에 수확하는 만기 재배 방법이 있다. 고구마의 재배기간 등 재배방법 개선으로 괴근의 유용성분을 극대화시키기 위하여 본 연구에서는 유용성분이 높게 함유된 유색 고구마 품종을 중심으로 재식간격 및 재배기간에 따른 괴근 수량과 유용성분 함량을 분석하여 적정 재식간격 및 재배기간 설정을 위한 기초자료로 활용하고자 하였다.
재료 및 방법
실험재료 및 고구마 수량 평가
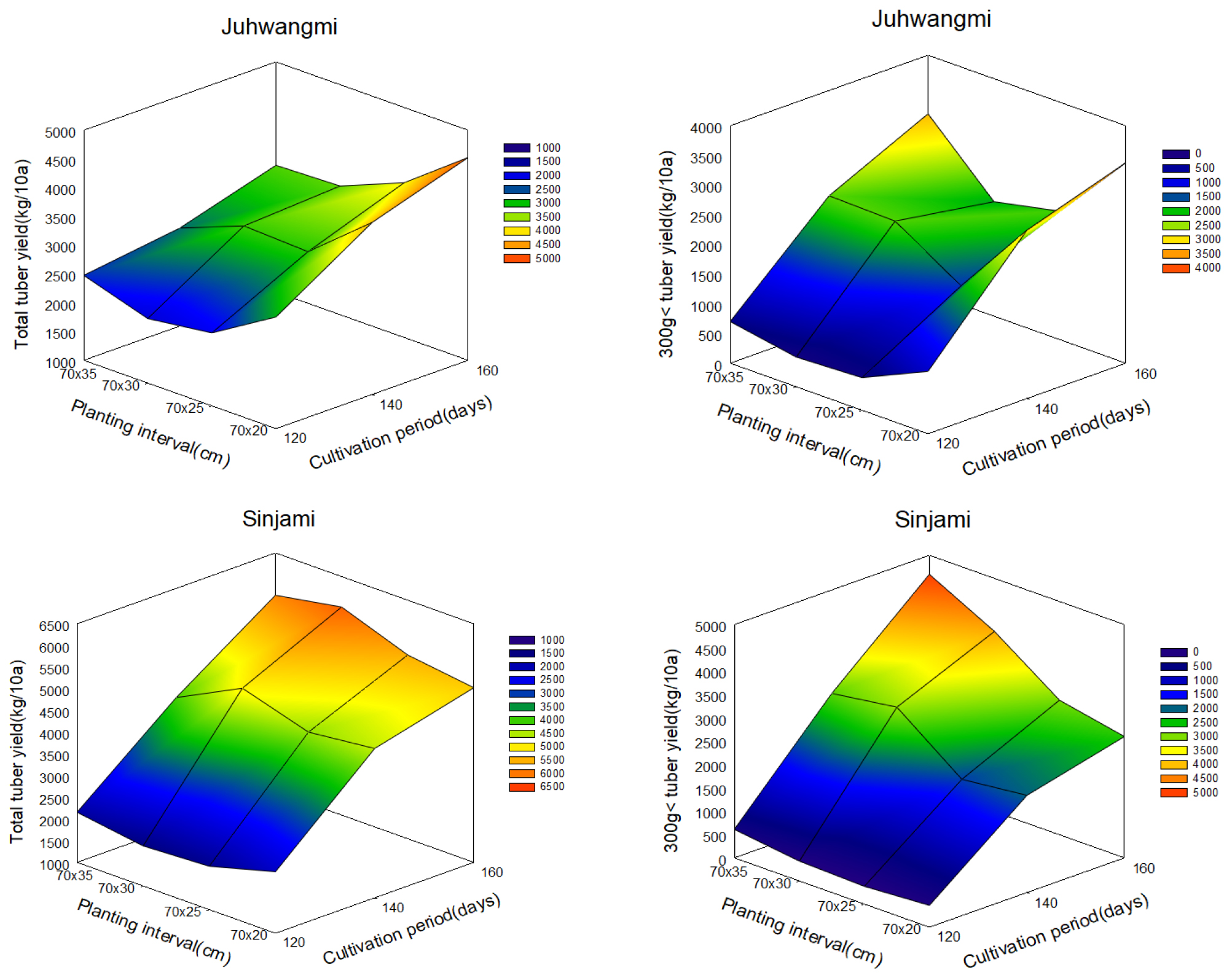
본 실험은 국립식량과학원 바이오에너지작물연구소 시험연구포장에서 수행되었다. 시험품종은 기능성물질이 풍부한 ‘주황미’(베타카로틴), ‘신자미’(안토시아닌) 품종을 선정하였으며, 재식간격 및 재배기간에 따른 괴근 수량 및 유용성분 함량을 조사하기 위해 표준시비량(N 5.5-P2O5 6.3-K2O 15.6-퇴비 1,000 kg/10a)을 살포하여 시험구를 조성하였다. 두 품종의 고구마 묘를 5월 17일에 재식간격 70×20 cm, 70×25 cm, 70×30 cm, 그리고 70×35 cm 간격 등 4처리와 수확시기는 120일, 140일, 160일 등 3시기로 구분하여 난괴법 3반복으로 실험하였다. 수량조사는 농촌진흥청 농업과학기술 연구조사분석기준에 준하여 실시하였다(RDA, 2012). 수확 후 처리별 10a당 수량은 총 수량과 가공용으로 적합한 300 g이상 수량을 구분하여 각 시험구당 3반복 씩 총 9개 샘플을 채취하여 조사하였다. 유용성분 분석을 위해 각 처리구 샘플들을 동결건조 하여 실험에 사용하였다. 또한 재식간격과 재배기간이 고구마 괴근 수량에 미치는 영향을 Sigma plot 10 (San Jose, CA)사용하여 3차원 프로파일(Fig. 1)로 나타내었다.
베타카로틴함량
베타카로틴분석은 식품공전 시험법 해설서(Ministry of Food and Drug Safety, 2002)에 따라서 100 μg에 해당하는 시료를 취하여 갈색 원심분리관에 넣고 3% 피로갈롤 에탄올 용액 10 μl과 60% 수산화칼륨 용액 1 μl을 가하여 70°C 항온수조 중에 30분 간 진탕하며 비누화하였다. 이를 차갑게 식힌 후 1% 염화나트륨 용액 22.5 mL과 헥산:초산에틸(9:1) 혼합용액 15 μl을 넣고 10분간 진탕하였다. 2,000 rpm에서 5분간 원심분리하여 상층액을 갈색플라스크로 옮긴 후 하층액에 헥산:초산에틸(9:1) 15 μl을 넣고 반복적으로 2회 추출하여 상층액을 합하였다. 감압농축 후, 에탄올 50 μl에 녹여 시험용액으로 하였다. HPLC의 분석조건(검출기 파장 450 nM 칼럼온도 40°C, 이동상 A용매-아세토니트릴:메탄올(85:15), B용매-디클로로메탄, 용매조건 : A용매(70%), B용매(30%), 유속 1.0 mL/분)을 맞춘 후 준비한 시험용액을 20 μl를 주입하여 검출하였다. HPLC (NANOSPACE SI-2, SHISEIDO, Japan)와 PDA Detector를 사용하여 아래의 식을 이용하여 건조분말 g당 함량을 구한 후 10a당 총 수량과 300 g이상 수량에 건물률을 각각 적용하여 산출하였다.
C : 시험용액 중의 베타카로틴 농도 (μg/mL)
a : 시험용액의 양(mL), b : 희석배수(적용될 경우), S : 시료 채취량 (g)
1/1,000 : 단위 환산 계수
안토시아닌함량
총 안토시아닌(cyanidin-3-glucoside equivalents) 함량은 pH differential method (Lee et al., 2005)를 응용하여 분석하였다. 고구마 괴근 동결건조 분말 0.25 g에 0.1% HCl이 함유된 Methanol 10 μl을 혼합하여 10분간 3회 초음파 처리 후, 추출액을 원심분리하여 상등액을 분리하였다. 상등액은 0.45 μm membrane filter (PTFE, 13 mm, Whatman)를 이용하여 50 μl를 얻었고 25 mM potassium chloride buffer (pH 1.0)와 400mM sodium acetate buffer (pH 4.5)를 950 μl씩에 각각 혼합한 후 15분간 발색시켰다. 반응액은 UV/Vis spectrophotometer (GB/Libra S22, Biochrom, UK)를 이용하여 520 nm와 700 nm에서 각각의 흡광도를 측정하였으며 총 안토시아닌 함량은 아래의 식을 이용하여 건조분말 100 g 당 함량을 구한 후 10a당 총 수량과 300 g이상 수량에 건물률을 각각 적용하여 산출하였다.
A = (OD520 nm - OD700 nm)pH1.0 - (OD52 0nm – OD700 nm)pH4.5
MW (Molecular weight) = 449.2 g/mol (cyanidin-3-glucoside의 1 mol 당 분자량)
DF (Dilution factor) = 20(희석배수)
10 = 추출액 총 부피
400 = 시료 100 g 당 안토시아닌 함량으로 환산하기 위해 시료 중량인 0.25 g으로 나눈 값
ε = 26,900 (molar absorptivity)
총폴리페놀 함량
총폴리페놀 함량은 Lee et al. (2010)의 방법을 응용하여 측정하였다. 고구마 괴근 동결건조 샘플 1 g에 80% 메탄올을 혼합 후 상온에서 24시간동안 진탕하여 추출하였다. 추출액 100 μl에 증류수 900 μl와 2 N Folin & Ciocalteu’s phenol reagent (Sigma-Aldrich Co., Switzerland) 500 μl를 혼합하고 20% Na2CO3 용액 2.5 μl를 첨가 후 실온에서 20분 반응시켰다. 반응액은 UV/Vis spectrophotometer를 사용하여 735 nm에서 흡광도 값을 측정하였다. 표준물질로 chlorogenic acid (HWI, Germany)를 사용하여 검량선을 작성하였으며, 시료 100 g 중의 g chlorogenic acid로 나타 낸 후 10a당 총 수량과 300 g이상 수량에 건물률을 각각 적용하여 총폴리페놀 함량을 산출하였다.
플라보노이드함량
총 플라보노이드 함량은 Jeong et al. (2015)의 방법에 따라 시료용액(200 μg/μl) 0.5 μl과 diethylene glycol 5 μl를 혼합 후 1 N NaOH용액 0.5 μl 첨가하여 잘 섞은 후 30°C에서 1시간 반응시킨 후 420 nm에서 흡광도를 측정하였다. 표준검량곡선은 quercetin (Sigma Co., St. Louis, USA)을 사용하여 작성하였으며, 표준곡선 작성에 이용한 quercetin (QE, Sigma-Aldrich, 미국)의 농도는 50, 100, 250, 500 및 1000 μg/μl이었다. 플라보노이드 함량은 시료 100 g중의 g quercetin으로 나타낸 후 10a당 총 수량과 300 g이상 수량에 건물률을 각각 적용하여 총폴리페놀 함량을 산출하였다.
통계분석
SPSS 소프트웨어 버전 20 (IBM, Chicago, IL, USA)을 이용하여 p<0.05 수준에서 Tukey의 다중범위 검정으로 시료간의 유의성을 검정하였고, 데이터는 6~15반복의 평균값으로 나타내었다.
결과 및 고찰
고구마 품종별 재식 간격 및 재배 기간에 따른 괴근 수량 비교
고구마의 적정 재식밀도는 품종, 재배시기, 수확시기 및 괴근 크기별 생산 목적 등에 따라 영향을 받는다(Kim et al., 2006). 고구마 재배 시 재식간격(70×20 cm, 70×25 cm, 70×30 cm, 70×35 cm) 및 재배 기간(삽식 후 120일, 140일, 160일)에 따른 고구마 두 품종 ‘주황미’와 ‘신자미’ 괴근의 총 수량과 가공용으로 적합한 300 g 이상 크기의 괴근 수량을 조사하였다(Table 1). 모든 재식 간격 조건에서 주황미의 경우 120일 재배구에 비해 140일과 160일 재배구의 총 괴근 수량은 약 9~54% 증가하였으며, 300 g 이상 괴근 수량은 약 170~339% 증가하였다. 신자미의 경우, 총 괴근 수량은 120일 재배구에 비해 140일과 160일 재배구에서 약 84~202% 증가하였으며, 300 g 이상 괴근 수량은 약 346~810%으로 증가율이 크게 나타났다. 또한 재식간격과 재배기간이 고구마 괴근 수량에 미치는 영향을 3차원 프로파일(Fig. 1)로 나타낸 결과, 두 품종 모두 재배기간이 길수록 총 괴근 수량과 300 g 이상 괴근 수량이 증가하는 경향을 나타내었으며, 주황미의 경우는 특히 다른 재식간격에 비해서 70×20 cm 정식구에서 재배기간이 길어질수록 총 괴근 수량과 300 g이상 괴근 수량이 가장 높게 나타났다. 이와 반대로 신자미의 경우, 동일한 재배기간 내에서 재식간격에 따른 총 괴근 수량의 변화는 큰 차이가 없었으나 300 g이상 괴근 수량은 140일과 160일 재배구에서 70×30 cm와 70×35 cm 정식구의 수량이 70×20 cm과 70×25 cm 정식구에 비해 높게 나타났다. 재식간격에 따른 고구마 수량평가는 다수 연구진에 의해 수행되었다(Guertala & Kembleb, 1997; Kim et al., 2006; Ming et al., 2011; Nam et al., 1997; Ruiz et al., 1980; Schultheis et al., 1999). Nam et al. (1997)의 연구 결과에 의하면 75×30 cm에서보다 75×20 cm 재배구에서 수량이 증가하였다고 보고하였다. 또한 Ramon et al. (2014)은 재식거리가 고구마 괴근 크기를 결정하는 중요한 요인으로 보고하였다. 일반적으로 삽식 후 120일이 지난 후 수확 시 재배간격이 30 cm에서 주당 괴근 수의 증가로 수량이 높게 나타나고, 그 이상의 재식거리는 수량이 감소한다고 하였다(Bouwkamp & Scott, 1980). 하지만 소형 고구마 생산을 목적으로 하지 않는 가공용 고구마 재배에서는 주간 거리가 35 cm보다 70 cm에서 높은 수량을 보였으며(Sulaiman et al., 2001), 품종에 따라 재식거리가 넓었을 때 최대 상저수량을 나타냈다(Mulkey & McLemore, 1992). 본 연구 결과와 같이 신자미의 경우 재식거리가 넓어질수록 300 g이상 수량이 증가하는 경향을 보였으나, 주황미의 경우에는 70×20 cm 정식구에서 재배기간이 길어질수록 300 g이상 수량이 가장높았으므로, 품종 별 특성, 재배방법 등을 고려하여 단위 면적당 생산되는 괴근 수량에 함유된 유용성분을 비교 분석하여 최적 재식거리 및 재배기간을 결정해야 할 것으로 생각된다.
Table 1.
Effects of planting interval and cultivation period on sweetpotato yield.
재식 간격 및 재배 기간에 따른 베타카로틴(주황미)과 안토시아닌(신자미) 함량 비교
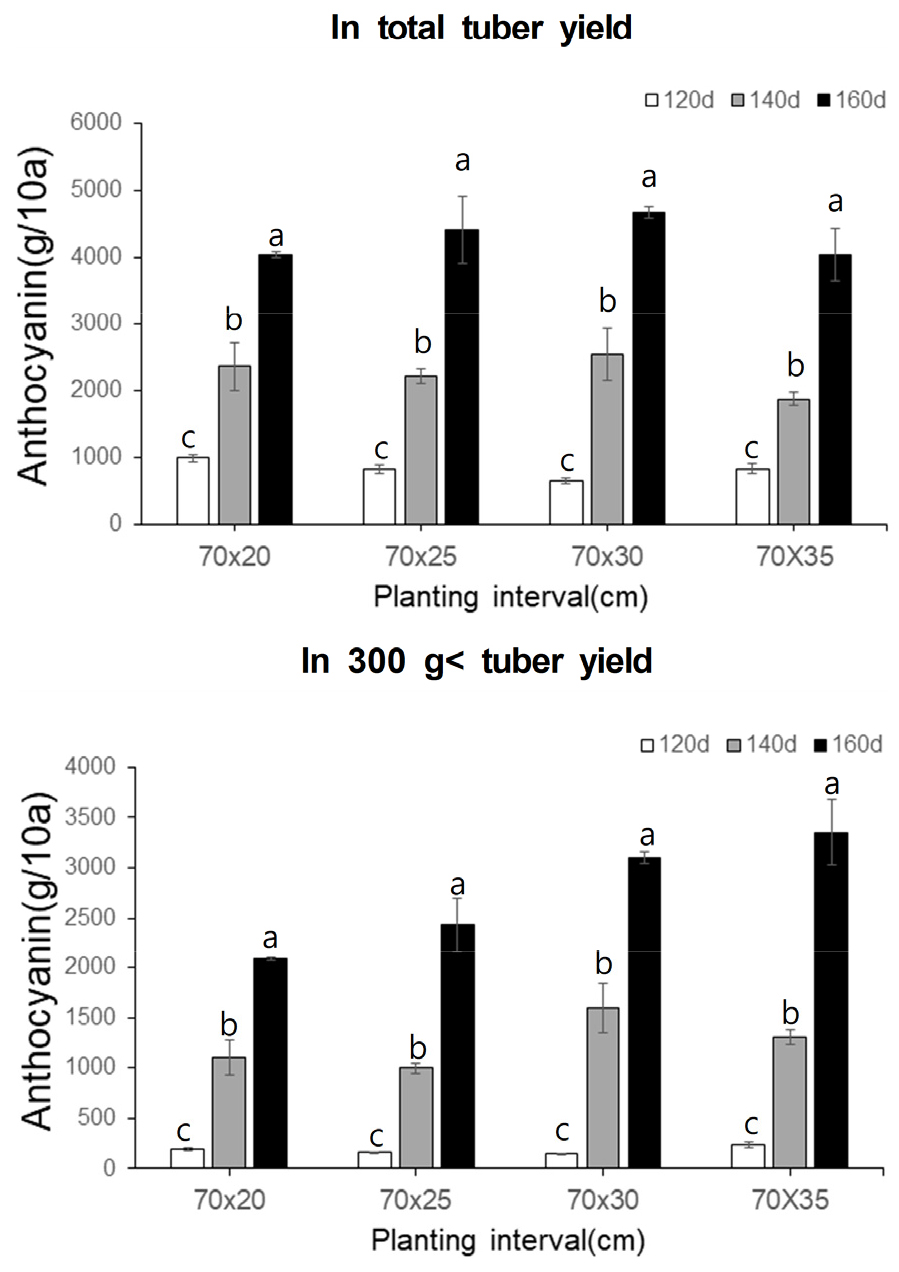
고구마 두 품종 ‘주황미’와 ‘신자미’는 각각 괴근색이 주황색과 자색을 나타내는 품종으로 주황미 괴근의 베타카로틴의 함량(Fig. 2)과 신자미 괴근의 안토시아닌 함량(Fig. 3)을 재식간격 및 재배기간별로 10a당 총 괴근 수량과 300 g이상 괴근 수량으로 환산하여 평가하였다. 그 결과 두 품종 모두 재배기간이 길수록 베타카로틴과 안토시아닌이 높은 수치를 나타냈다. 주황미의 경우 총 괴근 수량에 대한 베타카로틴 함량이 동일한 재식간격 내에서 재배기간 120일 대비 140일과 160일에서 5%~79%까지 증가하였다. 가공용으로 적합한 300 g이상 크기의 수량에 대한 베타카로틴 함량은 재배기간이 길수록 120일 대비 140일과 160일 재배 시 약 305~407%로 더욱 크게 증가하였다. 특히 70×20 cm 재배 간격에서 베타카로틴의 함량이 다른 재배간격에서 베타카로틴의 함량에 비해 가장 높게 나타났다. 이는 관수량을 감소시킴에 따라 고구마 괴근의 베타카로틴 함량이 증가한 결과와 유사한 결과로서 재식간격이 좁을수록 괴근 당 수분 공급량이 줄어들게 되어 베타카로틴의 함량이 증가한 것으로 보인다(Laurie et al., 2012). 이에 추가적으로 재식간격에 따른 토양수분함량의 경시적 변화를 확인하여 고구마 유용성분 함량에 미치는 효과를 명확히 구명할 필요가 있다. 한편 자색고구마 품종 신자미의 경우 역시 동일한 재식간격 내에서 안토시아닌 수량의 변화는 재배기간 120일 대비 140일과 160일에서 약 225~720%까지 크게 증가하였다. 동일한 재배기간 내에서 재식간격에 따른 총 안토시아닌 수량의 변화는 큰 차이가 없었으나 300 g이상 괴근 수량에 해당하는 안토시아닌 총 함량은 140일과 160일 재배구에서 70×30 cm와 70×35 cm 정식구의 수량이 70×20 cm과 70×25 cm 정식구에 비해 높게 나타났다. 재식간격을 넓게 하여 소식할수록 크기가 큰 괴근 수량이 증가(Kim et al., 2006; Schultheis et al., 1999)함에 따라 안토시아닌 총 함량은 높아졌으나, 더 명확한 구명을 위하여 괴근 크기별 안토시아닌 함량 분석 및 안토시아닌 생합성 유전자의 발현양상을 분석할 필요가 있다.
이와 같이 주황미의 베타카로틴과 신자미의 안토시아닌 함량 증대를 위한 최적 재식 간격이 상반된 경향을 보임에 따라 베타카로틴 가공용 주황미 품종은 70×20 cm 재배간격으로 밀식 재배하는 것이 유리하며, 안토시아닌 가공용 신자미 품종을 재배할 경우는 재식 거리를 70×30 cm와 70×35 cm 범위로 넓게 하는 것이 유리할 것으로 생각된다. 또한 5월 중순에 삽식하여 10월 중하순에 수확하는 보통기 재배를 실시 할 경우 150일~160일의 재배기간을 충족하게 되어 최적의 유용성분 함량을 얻을 수 있을 것으로 생각된다.
고구마 품종별 재식 간격 및 재배 기간에 따른 폴리페놀 함량 비교
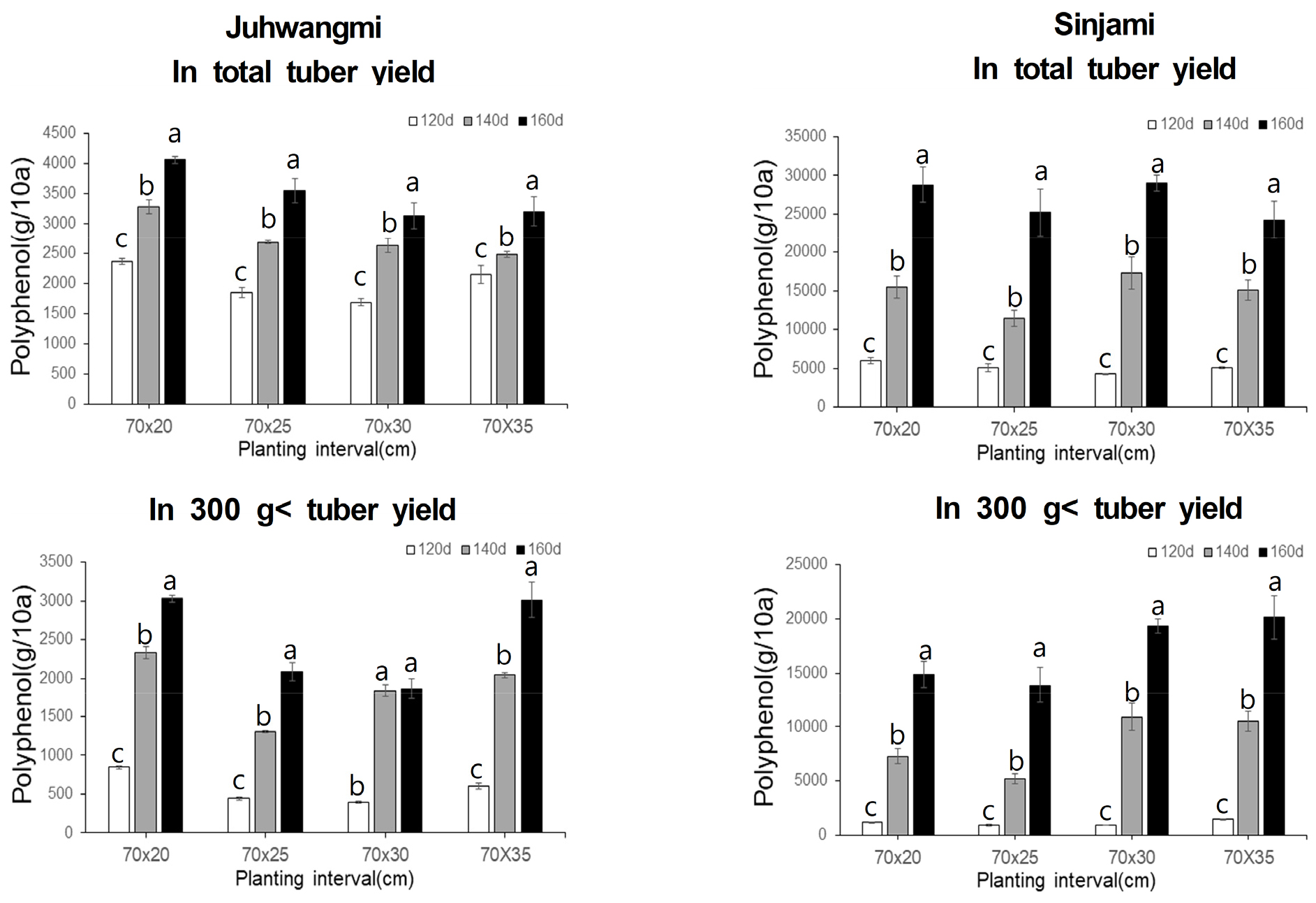
두 품종에서 재식 간격 및 재배기간에 따른 총 폴리페놀함량을 분석한 결과는 Fig. 4에서 보는 바와 같이 10a당 총 괴근 수량 및 300 g 이상 괴근에 대한 폴리페놀 함량은 신자미가 주황미보다 모든 구간에서 높게 나타났으며 많게는 10배 이상 차이가 났다. 10a당 총 괴근에 대한 폴리페놀 함량은 주황미의 경우 1,690~4,060 g로 나타났으며, 신자미의 경우에는 4,270~29,010 g 범위로 나타났다. 300 g 이상 괴근에 대한 폴리페놀 함량은 주황미의 경우 399~3,031 g로 나타났으며, 신자미의 경우에는 944~20,144 g의 범위로 나타났다. 두 품종 모두 재배기간은 160일에서 총 괴근 수량과 300 g이상 괴근 수량에 대한 폴리페놀 함량이 가장 높게 나타났으며, 재식밀도는 폴리페놀 함량이 높은 신자미의 경우, 총 괴근 수량에 대한 함량으로 비교했을 때는 모든 재식밀도 구간에서 큰 차이가 없었지만 300 g이상 괴근의 폴리페놀 함량은 70×30 cm 또는 70×35 cm에서 가장 높은 수치를 나타내었다. 이는 신자미의 안토시아닌 함량 결과와 같은 경향으로 재식밀도가 낮을수록 크기가 300 g이상 괴근 수량이 증가(Kim et al., 2006; Schultheis et al., 1999)함에 따라 폴리페놀 총 함량이 높게 나타났다.
고구마 품종별 재식 간격 및 재배 기간에 따른 플라보노이드 함량 비교
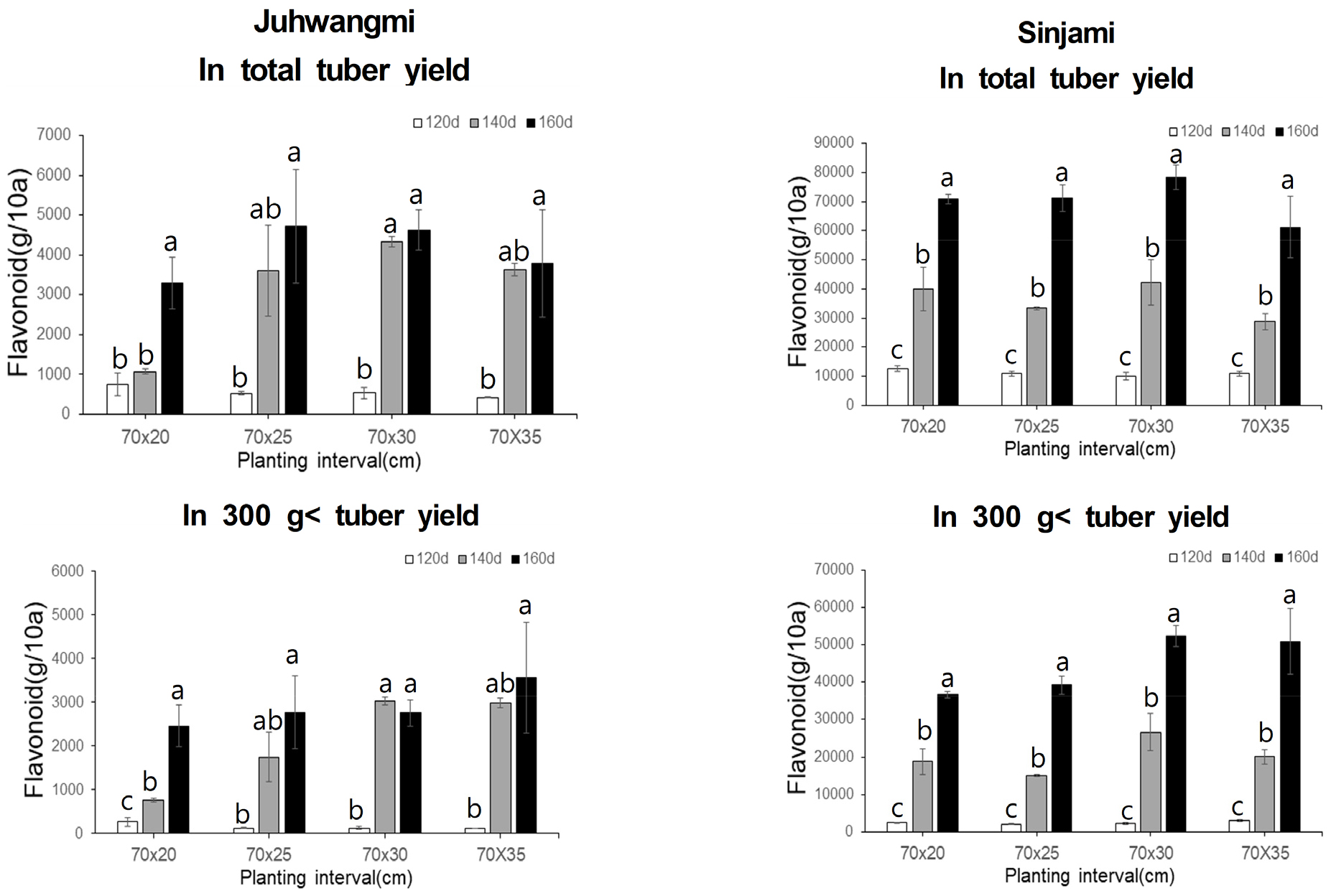
두 품종에서 재식 간격 및 재배기간에 따른 플라보노이드함량을 분석한 결과는 Fig. 5에서 보는 바와 같이 10a당 총 괴근 수량 및 300 g 이상 괴근에 대한 플라보노이드 함량도 폴리페놀 함량과 비슷하게 신자미가 주황미보다 모든 구간에서 현저히 높게 나타났다. 10a당 총 괴근에 대한 플라보노이드 함량은 주황미의 경우 421~4,716 g로 나타났으며, 신자미의 경우에는 9,943~78,369 g 범위로 나타났다. 300 g 이상 괴근에 대한 플라보노이드 함량은 주황미의 경우 119~3,569 g로 나타났으며, 신자미의 경우에는 2,053~ 52,228 g의 범위로 나타났다. 플라보노이드 함량이 주황미에 비해 월등히 높은 신자미의 경우로만 비교한 결과, 재배기간이 길수록 플라보노이드의 함량은 높게 나타났으며 재식밀도에 따른 플라보노이드 함량의 변화는 총 괴근 수량에 대한 함량으로 비교하였을 때는 뚜렷한 차이가 없이 비슷한 경향을 나타내었으나 300 g 이상 괴근의 플라보노이드 함량의 경우는 폴리페놀 함량의 결과가 비슷하게 70×30 cm 또는 70×35 cm에서 가장 높은 경향을 나타내었다. 따라서 고구마 작물의 수량 및 유용성분 함량은 재식 거리나 재배기간에 따라 영향을 받으므로 비용증가와 수량증가에 따른 경제성을 분석하여 적정 재식 거리 및 수확 시기를 결정할 필요가 있다고 생각한다(Schultheis et al., 1999).
적 요
본 연구에서는 유용성분 함유 고구마 품종의 대량생산을 위한 재배법 개발을 위하여 재식간격 및 재배기간에 따른 괴근 수량 및 다양한 유용성분 함량 분석을 수행하였다. 이러한 결과는 고구마 수량 및 유용성분 대량생산을 위한 재배법 개선에 유용한 정보를 제공해줄 것으로 생각된다.
1.두 품종 모두 재배기간이 길수록 총 괴근 수량과 300 g 이상 괴근 수량이 증가하는 경향을 나타내었다.
2.주황미의 경우 재식간격별 수량 조사 결과, 70×20 cm 정식구에서 재배기간이 길어질수록 총 괴근 수량과 300 g이상 괴근 수량이 가장 높게 나타났으며, 신자미의 경우에는 재식간격에 따른 총 괴근 수량의 변화는 큰 차이가 없었으나 300 g이상 괴근 수량은 140일과 160일 재배구에서 70×30 cm와 70×35 cm 정식구의 수량이 70×20 cm과 70×25 cm 정식구에 비해 높게 나타났다
3.주황미 괴근의 베타카로틴의 총 함량도 재배기간이 길수록 높은 수치를 나타냈으며 70×20 cm 재배 간격에서 베타카로틴의 함량이 다른 재배간격에서 베타카로틴의 함량에 비해 가장 높게 나타났다.
4.신자미 괴근의 안토시아닌의 총 함량 역시 재배기간 120일 대비 140일과 160일에서 크게 증가하였다. 재식간격에 따른 총 안토시아닌 수량의 변화는 큰 차이가 없었으나 300 g이상 괴근 수량에 해당하는 안토시아닌 총 함량은 140일과 160일 재배구에서 70×30 cm와 70×35 cm 정식구의 수량이 70×20 cm과 70×25 cm 정식구에 비해 높게 나타났다.
5.총 폴리페놀 및 플라보노이드 함량을 분석한 결과 두 함량 모두 주황미 보다 신자미가 현저히 높은 함량을 나타내었으며, 160일 재배구에서 가장 높게 나타났다. 특히 300 g이상 괴근의 두 유용성분의 함량은 70×30 cm 또는 70×35 cm에서 가장 높은 수치를 나타내었다.
6.고구마 유용성분 대량 생산을 위한 재배방법으로 두 품종 모두 재배기간은 160일이 적합하였으나 재식밀도는 주황미의 경우 특히 70×20 cm 재배 간격에서 베타카로틴의 함량이 다른 재배간격에서 베타카로틴의 함량에 비해 가장 높게 나타났으며, 신자미의 경우는 70×30 cm 또는 70×35 cm에서 300 g이상 괴근의 유용성분 총 함량이 높은 경향을 나타내었다