서 론
참깨(Sesamum indicum L.)는 참깨과(Pedaliaceae)에 속하는 1년생 초본 식물로 아시아 및 아프리카 지역에서 주로 재배되는 유지작물이다(Anilakumar et al., 2010). 참깨 종자와 참기름은 전 세계적으로 소비되고 있으며 유럽과 미국에서의 소비가 증가하고 있는 추세이다(Morris, 2002). 특히 참깨 종자와 참기름에 함유되어 있는 리그난은 대표적인 기능성 물질로 리그난의 대표적인 성분으로는 세사민과 세사몰린이 있다(Namiki, 1995). 리그난은 체내의 활성산소로부터 야기되는 다양한 질병을 억제할 수 있으며(Kumar & Singh, 2015), 또 간의 콜레스테롤 축적을 막는 효과(Ogawa et al., 1995), 지방산 대사 억제 효과(Lim et al., 2007), 항치매 효과(Matsumura et al., 2016) 등이 알려져 있다. 따라서 리그난 함량은 참깨 종자를 평가하는데 중요한 지표 성분이다. 현재 우리나라의 참깨 자급률은 15% 미만으로 대부분 수입에 의존하고 있으며 저가인 수입산 참깨로 인해 국산 참깨의 경쟁력은 감소하고 있다. 반면 건강에 관심 및 기능성 식품의 선호도 증가로 인해 국산 참깨의 수요량은 더욱 증가할 것으로 예상된다. 따라서 수입산 참깨와 차별화를 할 수 있는 기능성 물질이 다량 함유된 참깨가 요구되고 있다. 이에 고리그난 참깨 육종은 중요한 육종 목표 중 하나이며 고리그난 계통을 초기 세대에 선발하기 위한 모델 구축이 필요한 실정이다.
현재 작물에 함유된 일정 성분을 정량하는 방법은 각 시료의 목적하는 물질 별로 추출 및 분리하는 것이 대표적인 방법인데 이러한 방법은 과다한 시간과 노력이 소요된다(Kim et al., 2014). 이러한 문제점 때문에 전처리 과정 없이 빠르게 분석할 수 있는 근적외선분광기(NIRS: near infrared reflectance spectroscopy)를 이용한 비파괴적 정량 분석 방법이 대두되고 있다. NIRS는 근적외선이 시료에 조사될 때 시료내 특정 작용기가 분자 진동을 일으키고 특정 파장의 빛을 흡수하게 되는데 이러한 흡광 정도는 시료 내 작용기 농도에 비례한다는 램버트 비어 법칙에 근거한 정량분석 방법이다(Oh et al., 2017). 현재 NIRS를 이용한 분석 방법은 육종 소재를 대량 평가하는 데 널리 사용되고 있다. NIRS를 이용한 콩의 지방산 및 단백질 분석(Choi et al., 2016)과 안토시아닌 분석(Kim et al., 2008), 밀의 글루텐 분석(Salgó & Gergely, 2012), 벼의 아밀로스 분석(Sampaio et al., 2018) 등의 연구가 보고되었으며 참깨는 지방산 분석(Sato et al., 2003) 및 리그난 분석(Xia et al., 2020)을 수행한 바 있다. Kim et al. (2006)에 따르면 총 93점의 국내 참깨 종자를 NIRS분석을 통해 참깨의 리그난 함량을 조사하였다. 세사민과 세사몰린의 검량식 결정 계수 값은 각각 0.947과 0.906이 나왔으며 검량식 확인(cross-validation)을 위한 결정 계수 값은 0.837와 0.784로 조사되었으나 실험에 사용된 참깨 시료의 수가 적고 리그난 함량의 범위가 좁아 NIRS 분석에 있어 객관적인 시료의 모집단을 구성하고 스펙트럼의 다양성을 설명하기 위해서는 다른 환경에서 생산된 많은 수의 시료가 필요하다고 판단되었다. 따라서 본 연구에서는 좀 더 많은 참깨 종자의 리그난 함량을 NIRS을 통해 분석하였다.
본 연구에서는 참깨의 고리그난 육종 소재를 초기에 빠르고 정확하게 선발하기 위하여 참깨 종자 482점을 조사하여 검량식을 작성하였으며, 이를 바탕으로 추가적인 검증을 통해 참깨의 고리그난 자원 선발 모델을 구축하였다.
재료 및 방법
시험 재료
본 연구에 사용된 시험 재료는 참깨의 품종, 유전자원, 우량계통 및 재조합자식계통 종자 등이며 농촌진흥청 국립식량과학원 남부작물부 시험포장에서 2018년, 2019년, 2020년에 생산하였다. 재배는 흑색 참깨 전용 유공 비닐을 피복하고 조간 거리, 주간 거리는 각각 30 cm, 15 cm로 하였으며 5월 중순에 파종하여 8월 하순에 수확하였다. 시비는 질소, 인산, 칼리를 성분량으로 10a 당 각각 2.9, 3.1, 3.2 kg을 전량 기비로 사용하였다.
리그난 함량 분석
참깨의 리그난 함량 분석은 HPLC (Dionex 3000, Thermo Fisher, USA)를 사용하여 분석하였다. 분석 방법은 참깨 시료 1.0 g을 분쇄한 후 100% Methanol (MeOH) 20 mL를 첨가하여 24시간 동안 상온에서 회전식 교반기(Eyela JP/mm S-110)를 이용하여 추출하였다. 추출 용액의 상등액을 syringe filter (Whatman 0.2 µm, NYL)를 이용하여 여과한 후 HPLC분석 시험용액으로 사용하였다. HPLC 분석 조건은 mobile phase를 MeOH과 증류수로 하였으며 MeOH의 비율은 60% (v/v)이다. 칼럼은 YMC Triart C-18 (1.9 µm, 2.0 × 50 mm, 30°C)을 사용하였고 유속은 0.3 mL/min이며 검출기는 diode- array Detector UV 290 nm로 15분간 분석하였다.
근적외선 스펙트럼 측정
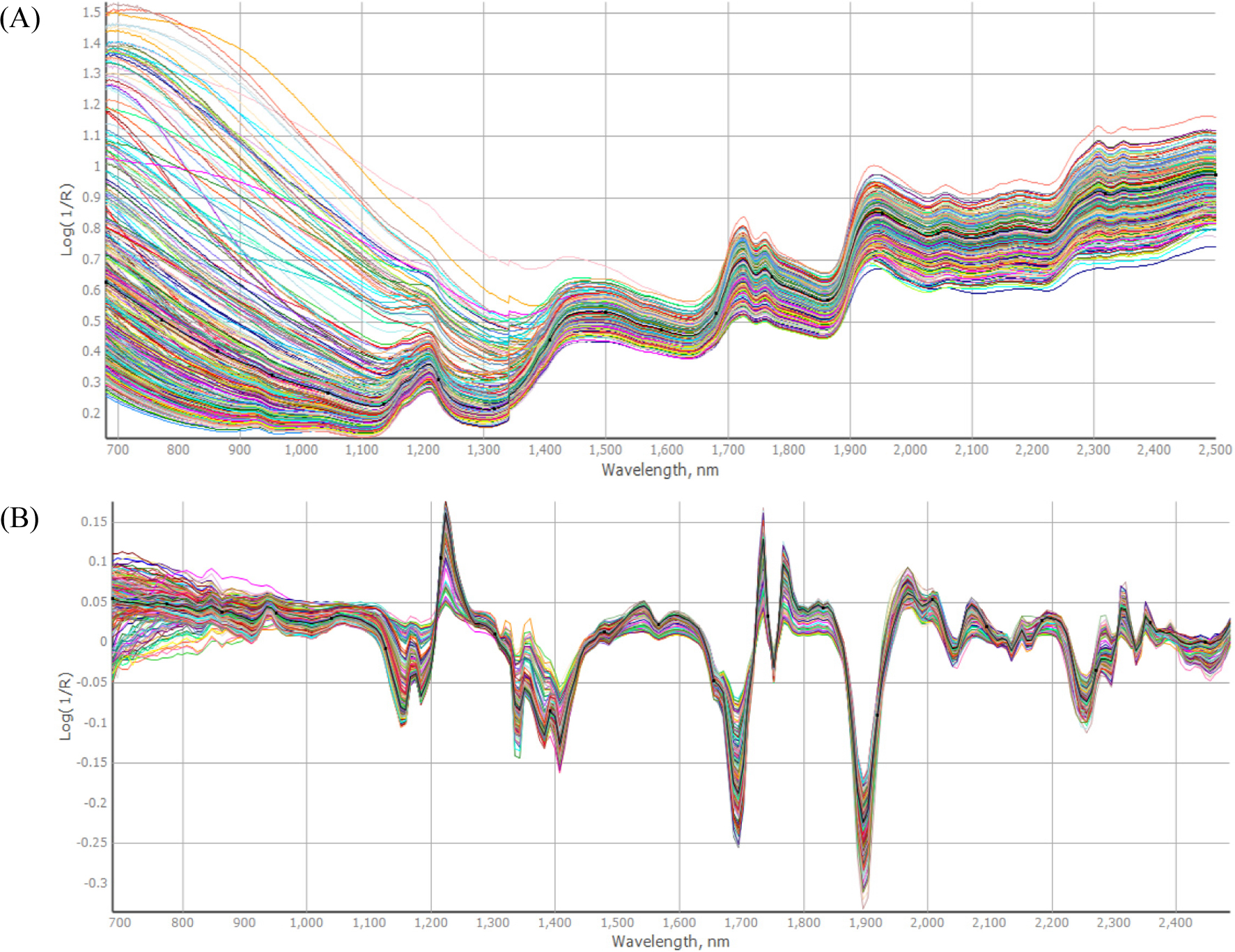
참깨의 품종 및 유전자원 482점의 근적외선 스펙트럼을 측정하기 위해 NIR 분광기기 Spectra star 2500 (Unity Scientific, Columbia, MD, USA)를 이용하였다. 시료컵에 참깨를 충진하여 공극을 최소화 시키고 실온에서 680-2500 nm의 파장 범위에서 1.0 nm 간격으로 측정한 후 검량식 유도를 위해 흡광도(log 1/R, R = reflectance)로 변환하여 스펙트럼을 수집하였다.
NIRS 검량식 작성 및 검증
검량식은 Standard Normal Variate and Detrending (SNV-D) 전처리 기법을 통해 시료 입자의 크기, 수분, 밀도 등 물리적인 성질에 의한 스펙트럼 산란 현상을 보정하였으며 수처리(Math Treatment), 회귀분석과 같은 일련의 연속적 처리과정을 거쳐 검량식을 작성하였다. 수처리는 1, 8, 8, 1 (1st derivative, 8 nm gap, 8 point smooth, 1 point second smooth)을 적용하였으며 회귀분석은 부분최소제곱법(Partial Least Square, PLS)을 사용하였다. 리그난 HPLC 분석 값과 NIRS 측정값의 통계적 해석과 상관관계 분석은 UCal 4.0 (Unity Scientific, Milford, MA, USA)를 이용하였다. 최적의 검량식을 얻기 위해 결정 계수(RSQ, R2), Standard error of calibration (SEC), Standard error of cross-validation (SECV) 등의 통계치를 고려하여 선별하였다.
작성된 검량식의 적용가능성을 검증하기 위해 검량식 작성에 이용되지 않은 2020년에 생산된 참깨 종자 90자원의 리그난 함량을 NIRS를 이용하여 측정하였다.
결과 및 고찰
검량식 작성을 위한 HPLC 분석 값을 얻기 위해 참깨 482점에 대한 리그난 분석을 수행하였다(Table 1). 세사민의 함량 범위는 0.03-14.40 mg/g, 평균 4.93 (±3.414) mg/g이며 세사몰린의 함량 범위는 0.10-3.79 mg/g, 평균 1.74 (±0.825) mg/g으로 조사되었다. Wang et al. (2013)에 따르면 중국에서 재배한 참깨의 세사민의 함량 범위는 0.82- 11.05 mg/g이었고 세사몰린의 함량 범위는 1.35-6.96 mg/g 이었으며 Rangkadilok et al. (2010)의 연구에서는 태국에서 재배한 참깨의 세사민 함량 범위는 0.01-7.23 mg/g, 세사몰린 함량의 범위는 0.01-2.25 mg/g 이었다. 이와 비교하였을 때 본 실험에서 사용한 시료의 참깨 종자에 함유된 세사민 및 세사몰린의 함량 변이 폭이 더 넓게 나타났으며 이는 NIRS를 이용한 리그난 함량 정량 분석에 유리하게 적용될 수 있을 것으로 사료된다.
NIRS를 통해 참깨 종자의 리그난 함량을 분석하기 위해 680-2500 nm에서 1.0 nm 간격으로 스펙트럼을 얻었다. Fig. 1A는 참깨 종자의 전체 스펙트럼을 나타낸 것으로 스펙트럼의 변이 폭이 넓게 나타났다. 시료의 밀도, 온도, 입자 크기 등의 차이로 인한 산란 차에 의해 바탕선의 변화가 발생하게 되며 이러한 변화는 검량식 작성에 많은 오차를 유발하게 된다(Park et al., 2012). 따라서 수처리 방법으로 바탕선의 변동 및 흡광도의 방해 요인으로 인한 오차를 보정할 수 있으며 본 실험에서는 1차 미분으로 보정한 후(Fig. 1B) 1, 8, 8, 1 (1st derivative, 8 nm gap, 8 points smooth, 1 point second smooth) 조건을 사용하였다. 본 실험에서 회귀분석 법으로 PLS법을 적용하였다. PLS법은 부분최소자승법으로 복잡한 근적외선 스펙트럼을 가지고도 여러 혼합물 형태의 시료를 분석할 수 있고 여러 파장과 조성, 물성 간의 상호관계를 만들어 검량 하기 위한 최적의 방법으로 알려져 있다(Cho et al., 2011). PLS법은 벌꿀의 수분이나 당 성분 등 품질 평가하는데 적용되기도 하였으며(Cho & Ha, 2002), 녹차의 폴리페놀 함량을 측정하는 데에도 적용된 바 있다(Chen et al., 2008).
Table 1.
Reference value of sesamin and sesamolin for calibration in 482 sesame samples (unit: mg/g).
| Constituent | Min | Max | Mean | SD |
| Sesamin | 0.03 | 14.40 | 4.93 | 3.414 |
| Sesamolin | 0.10 | 3.79 | 1.74 | 0.825 |
실험실에서 얻은 리그난 함량 값을 이용하여 NIRS 검량식 작성 결과는 Table 2와 같다. 세사민 함량에 대한 R2 값은 0.936, SEC 값은 0.861이었으며 세사몰린의 R2 값은 0.875, SEC 값은 0.292로 두 성분 모두 높은 수준의 R2 값을 보였다. 작성된 검량식의 정확도를 검증하기 위해 cross- validation한 결과 검량식 검정 결정계수(RSQV)와 표준오차(SECV)는 세사민 함량이 각각 0.889, 1.163이며 세사몰린 함량은 각각 0.781, 0.417을 나타냈다. 두 성분 cross validation한 값 모두 결정 계수는 낮아지고 표준오차는 증가하였다. 또한 세사민에 비해 세사몰린의 분석 값이 낮게 나왔으며 이는 세사민에 비해 세사몰린의 함량 자체가 적을 뿐만 아니라 세사몰린 간의 함량 변이가 적었기 때문이다. Kim et al. (2008)에 따르면 검정콩에 함유된 안토시아닌의 개별색소 C3G, D3G, Pt3G의 상관계수 값이 각각 0.952, 0.936, 0.833이었으며 이는 NIRS를 이용하여 안토시아닌 함량을 분석할 수 있다고 판단하였기에 본 연구에서 참깨 리그난 햠량을 HPLC 기기 분석을 하지 않고 NIRS를 통한 비파괴 분석을 적용하기에 충분한 것으로 사료된다.
Table 2.
Statistics of calibration and cross-validation of sesamin and sesamolin in sesame seeds.
|
Number of samples to keep |
Number of samples reject | Calibration | Cross validation | ||||
| RSQz | SECy | RSQVx | SECVw | ||||
| Sesamin | 364 | 118 | 0.936 | 0.861 | 0.889 | 1.163 | |
| Sesamolin | 372 | 110 | 0.875 | 0.292 | 0.781 | 0.417 | |
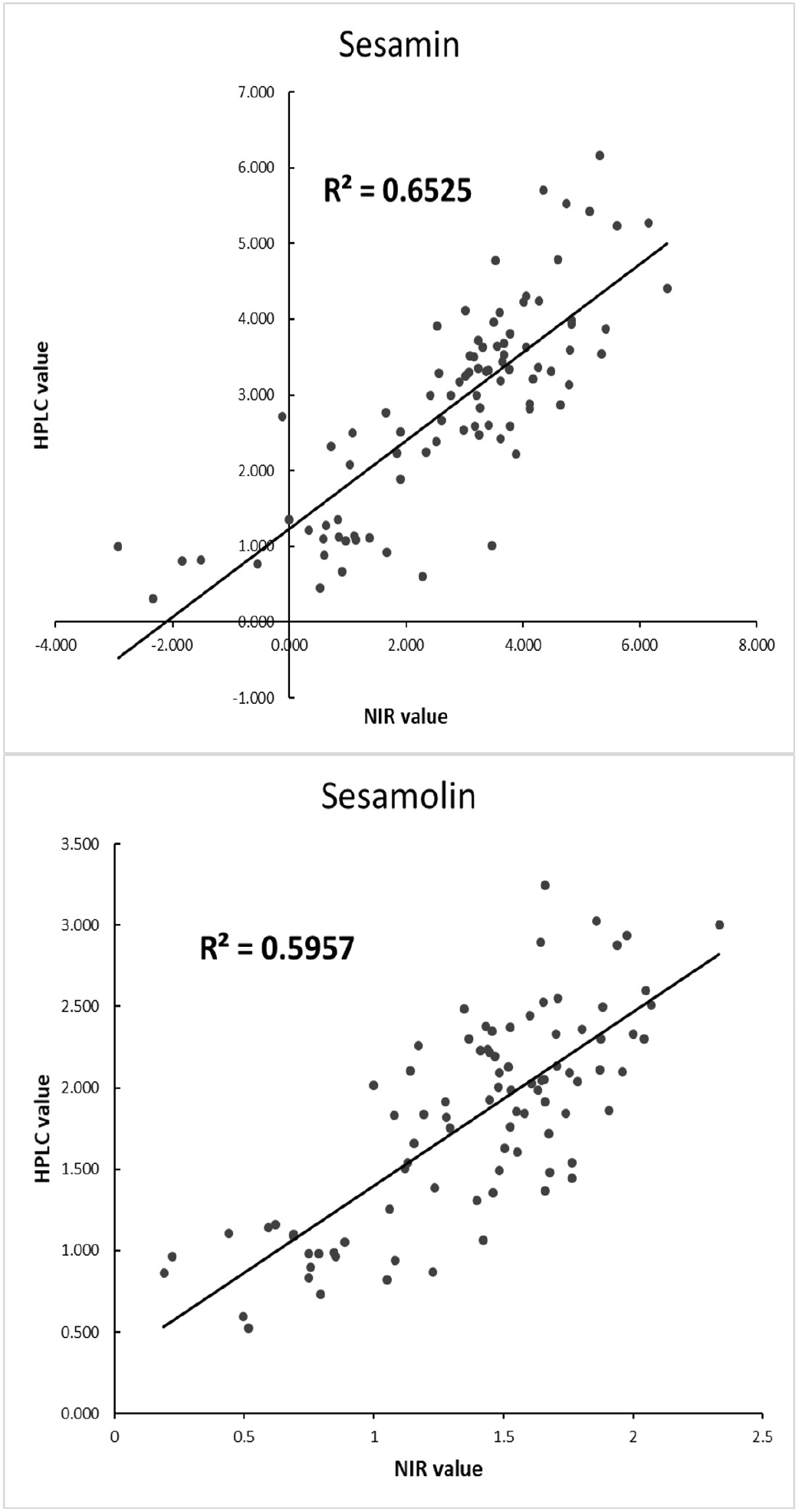
작성된 검량식의 정확도를 확인하기 위하여 2020년에 생산된 참깨 유전자원 90점을 통해 검증하였다. 우선 HPLC 분석 결과 세사민의 함량 범위는 0.31-6.16 mg/g, 평균은 2.87 (±1.332) mg/g이며, 세사몰린의 함량 범위는 0.52-3.24 mg/g, 평균은 1.81 (±0.622) mg/g으로 조사되어 검량식 작성에 사용된 시료의 리그난 함량 범위 내에 분포하였다(Table 3). 앞서 작성된 검량식의 적용가능성을 검증하기 위하여 참깨를 NIRS검량식에 적용하여 세사민 및 세사몰린의 성분을 분석한 결과 R2 값이 각각 0.653, 0.596으로 조사되었다(Fig. 2). 참깨 계통을 선발할 때에는 계통 별 리그난 함량을 정밀하게 측정하기 보다는 상대적 함량이 높은 계통을 선발하는 것을 목표로 하고 있어 리그난 함량이 높은 상위 30%의 자원을 선발하는 데는 본 실험에서는 표본의 크기가 크고 리그난 함량 범위가 다양하기 때문에 충분히 활용할 수 있을 것으로 사료된다. 따라서 본 연구에서 작성된 NIRS 검량식이 육종 초기에 참깨의 고리그난 자원을 선발하는데 적용될 수 있을 것이라 판단된다.
적 요
본 연구는 참깨에 함유된 세사민 및 세사몰린의 함량을 비파괴적으로 신속하게 평가하기 위하여 NIRS 분석을 이용해 검량식을 작성하고 검량식의 적용가능성을 검증하였다. 검량식 작성에 사용된 482점 참깨의 HPLC 분석 결과를 NIRS 스펙트럼에 적용시킨 후 검량식을 작성하였다. 세사민 및 세사몰린의 R2 값은 각각 0.936, 0.875로 조사되었으며 이를 cross validation 한 결과에서도 각각 0.899, 0.781로 조사되어 리그난 함량 분석에 적용 가능할 것으로 판단되었다. 작성된 검량식의 적용가능성을 확인하기 위해 2020년에 생산된 참깨 유전자원 90종의 종자를 NIRS를 통해 분석한 결과 세사민 및 세사몰린의 R2값이 각각 0.653, 0.596으로 크게 낮아졌으나 리그난 함량이 높은 상위 30%의 자원을 선발하는데 무리가 없었다. 따라서 본 연구에서 작성된 NIRS 검량식은 육종 초기에 고리그난 함량을 선발하는데 적용 가능할 것으로 판단된다.