서 론
밀 염색체는 상동성(homology)을 가지고 있는 상동 염색체(homologous chromosome)와 유사성을 가지고 있는 동조 염색체(homoeologous chromosome) 및 상동성이 없는 비상동 염색체(non-homologous chromosome)로 Ph1 (pairing homoeologous I) 유전자에 의하여 구분된다(Chen et al., 1994; Moore, 2008). Ph1 유전자에 의한 상동성의 인지(recognition of homology)는 생식세포 분열(meiosis) 동안에 상동 염색체에서만 염색체 결합(chromosome pairing)이 이루어지는 염색체 행동의 주요 원인이다(Gill et al., 1993; Martinez-Perez et al., 1999). 상동 염색체는 동일한 염기서열을 가지고 있으며 이러한 상동성을 바탕으로 합사기 복합체(synaptonemal complex)가 형성되어 염색체 결합이 이루어지고 재조합 결절(recombination nodules)에 의하여 염색체 교차(crossover)가 일어나 최종적으로 염색체 재조합(chromosome rearrangement)이 일어난다(Terasawa et al., 2007).
밀에서 상동염색체 간의 염색체 재조합 외에 동조 염색체 또는 비상동 염색체 간의 염색체 재조합 발생은 종내(intraspecific)뿐만 아니라 종간 교잡(interspecific cross)에서 밀의 유전적 다양성 확장을 위해 매우 중요한 요소이다(Molnár et al., 2009; Fu et al., 2013) 밀의 유전적 배경내에서의 염색체 재조합이 아닌 외부의 영향에 의한 염색체 재조합은 염색체 절단(chromosome breakage)-접합(fusion)-교(bridge)의 순환이 중요하다(Lukaszewski, 1995). 염색체 재조합의 시발점인 인공 염색체 절단을 유발하는 대표적인 방법은 방사선 조사(radiation irradiation)가 있다(Kikuchi et al., 2009; Soni et al., 2020). 하지만 방사선 조사는 그 위험성이 인정되며 조사량에 따라 작물에게 심각한 손상을 초래할 뿐만 아니라 편이성이 용이하지 않은 단점을 가지고 있다. 이러한 단점을 보완하기 위하여 인공 염색체 절단을 유발시키는 화학물질인 5-아자시티딘(5-azacytidine)과 5-아자-2’-데옥시시티딘(5-aza-2’-deoxycytidine)이 사용되었다. 인공 염색체 절단을 유발원인 5-아자시티딘 (5-azacytidine)과 5-아자-2’-데옥시시티딘(5-aza-2’-deoxycytidine)은 편이성이 상대적으로 방사선 조사에 비해 용이하지만 독성이 있고 반감기가 짧아 처리의 문제점이 있다(De Las Heras et al., 2001).
시티딘 유사체인 제부라린은 5-아자시티딘 (5-azacytidine)과 5-아자-2’-데옥시시티딘(5-aza-2’-deoxycytidine)에 비해여 긴 반감기, 낮은 독성 및 수용액의 안정성이 좋을 뿐만 아니라 인공 염색체 절단을 유발하는 유발원으로 보고되었다(Piskala & Sorm, 1964; Christman, 2002; Marquez et al., 2005; Rao et al., 2007). 제부라린이 식물에 미치는 영향에 대한 연구는 많이 이루어지지 않았으며, 제부라린이 인공 염색체 절단을 유발하는 작용 원리(mechanism)은 밝혀지지 않았다. 단지, 인공 염색체 절단을 유발하는 전이인자(transposable elements)와 배우자세포를 파괴하는 유전자(gametocidal gene)이 DNA 메틸화 억제제인 제부라린에 의해 탈메틸화가 되면서 발현되어 인공 염색체 절단을 유발할 것이고 추정할 뿐이다(Tsujimoto, 2005).
이 연구에서는 생식세포 분열기에 제부라린을 처리함으로써 제부라린이 밀의 유전적 배경에서 동조 관계에 있는 야생 호밀 외래 염색체 간에 미치는 영향을 형광 핵산 혼성화(genomic in situ hybridization) 방법을 이용하여 염색체 행동을 확인함으로써 작물의 유전적 다양성 확장을 위한 염색체 수준의 생식세포 분열에 대한 기초자료를 제공하기 위하여 수행하였다.
재료 및 방법
식물재료
밀의 유전적 배경에서 동조 염색체 간의 염색체 조합에 제부라린의 영향을 알기 위하여 이중 일가 외래 염색체 첨가 밀 계통(wheat double monosomic addition lines)을 사용하였다. 이 계통을 육성하기 위하여 두 종류의 밀 이가 외래 염색체 첨가 계통(wheat disomic addition line)을 사용하였다(Kishii et al., 2004; Edit et al., 2018). 이 연구에서 이용된 계통의 게놈 구성 및 계통도는 Fig. 1에 나타내었다.
제부라린 처리
제부라린(zebularine, Sigma-aldrich, USA) 처리는 생식세포 분열이 시작되는 이삭을 채취하여 희석된 제부라린 수용액에 상온(room temperature)의 암조건에서 24시간 동안 담가 두어 이삭이 제부라린을 흡수하는 방식으로 처리하였다. 제부라린 처리 농도는 선행 연구에서 염색체 재조합의 빈도가 가장 높은 농도인 10 µM를 사용하였다(Cho et al., 2011a). 제부라린 처리 24시간 후, 이삭에서 약(anther)를 채취하여 에탄올과 초산을 3:1 비율로 혼합한 고정액(fixation solution)을 이용하여 5일 동안 상온에서 염색체를 고정하였다. 생식세포 분열 동안 염색체의 행동 관찰을 위해 사용하기 전까지 4°C에 보관하였다.
생식세포 분열 염색체 관찰
위상차 현미경(phase-contrast microscope, BX-53, Olympus, Japan)을 사용하여 생식세포 분열 동안 제부라린이 처리된 태사기(pachytene), 이동기(diakinesis), 중기(metaphase), 및 사분자(tetrad) 시기에 염색체가 고정된 약(anther)을 사용하여 화분 모세포(pollen mother cells)를 확인하였다. 각 시기별로 염색체 행동을 관찰한 슬라이드는 유전체 형광 혼성화(Genomic In Situ Hybridization, GISH)를 수행하기 전까지 -80°C에 보관하였다.
GISH를 수행하기 위하여 두 종류의 Leymus DNA를 형광 염색물질을 사용하여 염색하였다. L. mollis DNA는 녹색 형광물질인 fluorescein-12-dUTP (Roche, Swiss)로 염색하였으며, L. racemosus는 적색 형광물질인 tetramethyl-rhodamione-5-dUTL (Roche, Swiss)로 염색하였다. 탐침자(probe) 제작은 무작위 시발체 표시(random-primer labeling) 방법을 이용하여 각 형광물질로 염색된 탐침자를 제작하였다. 형광 탐침자를 염색체에 반응시키기 위하여 0.2 M NaOH이 녹아 있는 70% 에탄올 수용액에 덮개 유리(cover glass)가 제거되어 건조된 염색체가 노출된 받침 유리(slide glass)를 상온에서 5분 동안 담가 두어 이중나선 구조(double helix)로 된 염색체를 변성(denaturation)시켰다. 변성 후, 받침 유리는 냉각된 70, 90, 및 95% 에탄올에 순차적으로 5분간 탈수화(dehydration) 시켜 상온에서 건조시켰다. GISH 혼성화액은 50% 포름아미드(formamide), 10% 덱스트린황산(dextran sulfate), 50-500 ng 형광 탐침자, 2x 염분 구연산 나트륨(saline sodium citrate, SSC), 11.5 µg/µL 연어 정자(salmon sperm) DNA로 조성으로 이루어졌으며, 10 µL를 변성된 염색체가 있는 받침 유리에 분주하여 덮개 유리를 덮었다. 덮개 유리 테두리는 37°C에서 24시간 동안 염색체와 탐침자가 반응하는 동안 습윤상태(humidity condition)를 유지하였다. 혼성화 후, 덮개 유리를 제거하여 탐침자와 혼성화 된 염색체가 있는 받침 유리를 0.1% Triton X-100이 녹아 있는 2x SSC과 2x SSC에 각각 5분간 세척하였다. 공기 건조를 한 후, 1 ng/µL 4’,6-diamidino-2-phenylindole (DAPI)가 포함된 Vectashield mounting medium (Vector)를 한 방울 분주하고 덮개 유리를 덮어 형광 형미경(fluorescence microscope, Olympus Bx61)을 이용하여 관찰하였다.
통계분석
제부라린 처리에 따른 동조 염색체 사이의 염색체 조합에 대하여 무처리의 염색체 조합 비율을 기준으로 예상되는 비율의 적합성을 카이자승검정(x2-test)을 통하여 검정하였다. 통계처리는 통계프로그램 ‘R’을 이용하여 분석하였다(The R’ Project for Statistical Computing, https://www.r-project.org).
결과 및 고찰
밀의 유전적 배경에서 동조 관계에 있는 두 종류의 Leymus 염색체 사이의 조합을 개선하기 위하여 제부라린을 처리하였다. 밀 염색체에 대한 제부라린의 영향은 인공 염색체 절단을 유발하여 염색체 사이의 조합에 대한 원인을 제공한다(Cho et al., 2011a). 이러한 현상을 이용하여 생식세포 분열 동안 밀의 유전적 배경에서 동조 염색체 사이의 염색체 조합(chromosome association)을 GISH를 통하여 확인하였다(Fig. 2).
염색체 접합(chromosome pairing)이 일어나는 전기 초반(early prophase)의 염색체 행동(chromosome behavior)을 관찰하였다(Cai & Xu, 2007). 보통의 이중 일가 외래 염색체 첨가 밀 계통(wheat double monosomic addition line)의 두 Leymus 염색체는 염색체 접합이 일어나지 않았으며, 이 현상으로 각 Leymus 염색체는 독립적인 행동을 하는 것이 확인되었다(Fig. 2A). 이러한 현상은 이전 연구에서도 확인되었으며, 염기서열이 유사한 부분에서 부분 염색체 접합이 일어난다(Cho et al., 2011b). 보통의 이중 일가 외래 염색체 첨가 밀 계통에서 두 Leymus 염색체의 행동과 제부라린 처리 후의 두 염색체의 행동의 차이는 두 Leymus 염색체의 전장(whole length)에서 염색체 조합과 같은 현상이 일어난 것이다(Fig. 2B). 다만, L. racemosus와 L. mollis의 염색체 차이인 염색체 말단(telomeric end)의 이질염색질(heterochromatin) 부분에서는 염색체 조합과 같은 현상이 이루어지지 않았다. 이러한 결과는 Kishii et al. (2003)의 연구에서도 보고된 결과처럼 두 Leymus 염색체의 차이인 이질염색질 부분의 비대칭 결합(asymmetrical pairing) 현상과 동일하였다. 이러한 현상은 염색체 결합의 불균형 또는 상동성이 결여된 염색체 사이의 염색체 조합에 긍정적인 효과를 기대할 수 있다. 하지만, 무작위로 발생하는 인공 염색체 절단(chromosome breakage)은 기본적인 염색체의 길이에 영향을 주는 것으로 확인되었다(Fig. 2C and D). 이러한 현상은 염색체 조합이 이루어지는 부분의 제한이나 생식세포분열 동안 일어나는 두 번의 감수분열을 지나면서 불균형한 염색체 분리가 일어나 정상적인 구조를 형성하지 못하고 미소핵(micronucleus)의 형태로 염색체의 기능을 상실하는 경우도 발생한다(Cai et al., 2010; Rezaei et al., 2010). 그 외에도 부분적으로 염색체 결합이 이루어지고 일가 염색체로 존재하는 두 Leymus 염색체도 확인되었으며, 인공 염색체 절단으로 인하여 핵 안에 두 Leymus 염색체가 소실(chromosome elimination)되는 현상도 확인하였다(Fig. 2E and F). GISH를 통하여 확인한 염색체 이벤트의 빈도를 확인한 결과, 염색체 절단으로 두 Leymus 염색체가 없는 세포는 3.1%로 관찰되었으며, 두 Leymus 염색체에서 염색체 절단이 일어난 세포는 9.4%로 관찰되었다. 염색체 절단의 긍정적인 효과인 두 Leymus 염색체 간의 접합이 일어난 빈도는 4.7%로 관찰되었다(Table 1). 나머지 세포들은 일반적인 이중 일가 외래 염색체 첨가 밀 계통에서 나타나는 두 Leymus 염색체가 일가 염색체로 존재하는 것을 관찰하였다(Table 1).
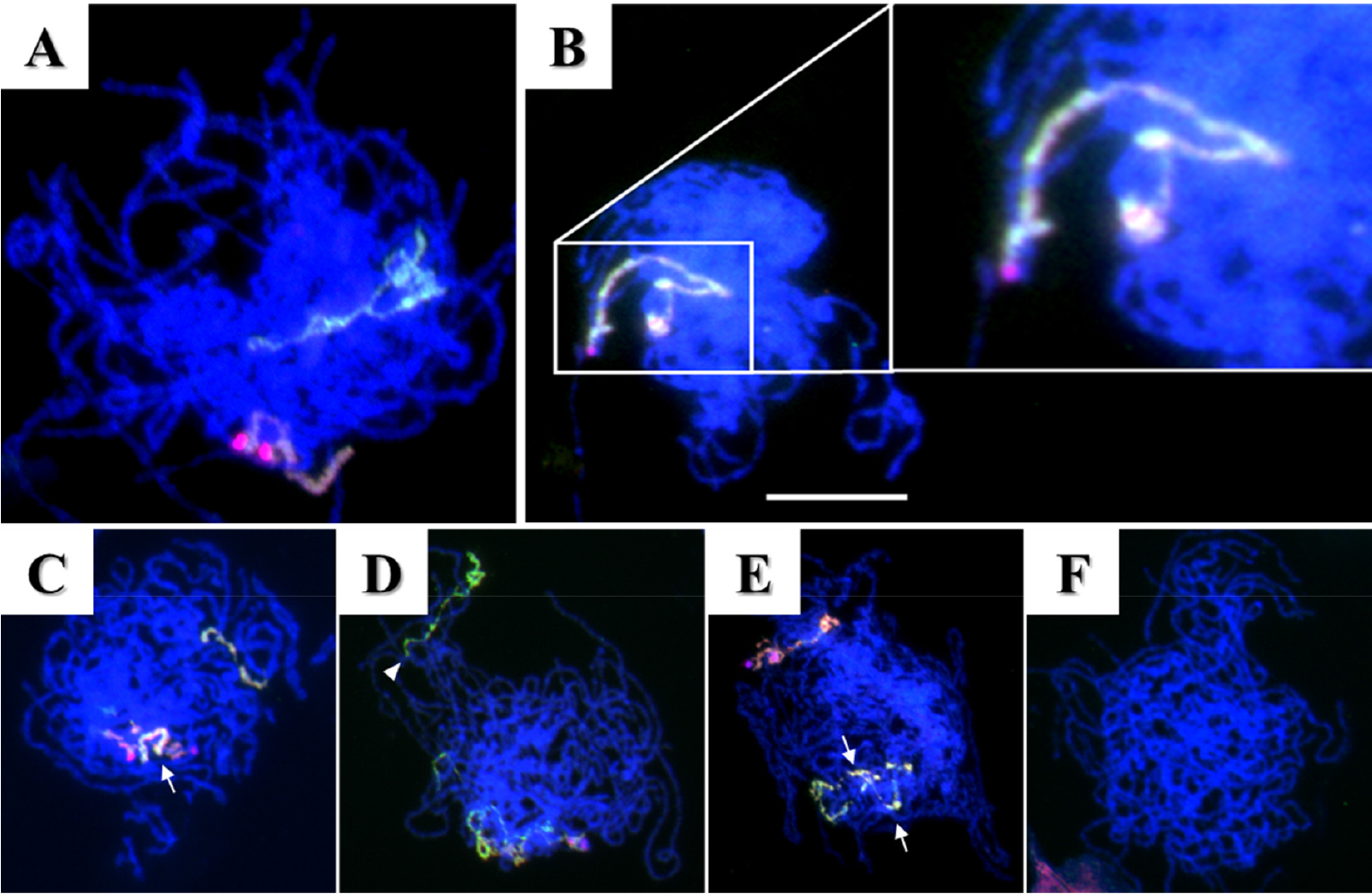
Fig. 2.
Chromosome behavior by chromosome breakage caused by zebularine during early prophase. The final concentration of zebularine was 10.0 µM. No chromosome association between homoeologous chromosomes (A); partial chromosome association between homologous or non-homologous chromosomes (B, C, and D); perfect chromosome association between homoeologous chromosome (E); and chromosome elimination by chromosome breakage (F). Each arrow indicates a paired region between two Leymus chromosomes. Scale bar, 10 µm.
Table 1.
Comparison of the frequency of chromosome association according to zebularine treatment during late prophase in meiosis.
| Early prophase | Types of meiotic chromosome behavior | ||||
| Pairing | Breakage | Without L.m and L.r* | Univalent | Total | |
| No. of cells | 3 | 6 | 2 | 53 | 64 |
| Frequency (%) | 4.7 | 9.4 | 3.1 | 82.8 | 100 |
염색체 결합의 결과로 이가 염색체가 확실히 구분되는 전기 후반(late prophase)의 염색체 행동을 관찰한 결과, 전기 초반에 염색체 결합이 이루어지지 않은 두 Leymus 염색체는 일가 염색체(univalent)의 형태로 존재하였다(Fig. 3A). 이와 같은 현상은 보통의 이중 일가 외래 염색체 첨가 계통의 일반적인 생식세포분열적 염색체 행동이다(Cho et al., 2011b). 부분적인 염색체 결합에 의한 일부가 결합(fusion)된 비정상적인 이가 염색체(bivalent)의 형태를 보였으나, 이러한 현상이 인공 염색체 절단에 의한 결합인지는 확실하지 않다고 판단된다(Fig. 3A). 그 이유는 보통의 이중 일가 외래 염색체 첨가 계통에서도 염기서열이 유사한 부분에서 이와 같은 결합이 일어나 비정상적인 이가 염색체의 형태가 일어나기 때문이다(Cho et al., 2011b). 반면, 인공 염색체 절단에 의한 결합으로 이가 염색체의 형태를 이루고 있는 염색체 조합을 확인하였다(Fig. 3C-E). 전기 초반에 염색체 말단의 이질염색질을 제외한 전장에서 염색체 결합이 이루어진 경우, 전기 후반의 전형적인 이가 염색체의 형태인 원(ring)형태를 이루는 이가염색체가 확인되었다(Fig. 3C). 또한, L. racemosus 염색체 말단의 이질염색질 부분이 확실히 구분되는 것도 확인하였다. L. racemosus 염색체 말단의 이질염색질 부분을 제외하고 진정염색질(euchromatin)부분에서 인공 염색체 절단에 의한 부분결합으로 인한 일가 염색체와 형태가 유사한 이가 염색체도 관찰되었다(Fig. 4D). 이러한 형태의 이가 염색체가 형성되려면 진정염색질 전장에서 많은 빈도의 인공 염색체 절단이 일어나고 그로 인하여 결합된 결과로 예측된다. 이러한 형태의 염색체는 Zhang et al. (2008)에 의해 보고된 “Zebra” 염색체와 매우 유사한 형태를 보이고 있으며, 이러한 형태의 염색체는 육종의 유전적 다양성 확장에서 매우 의미가 있다고 생각한다. 결국, 염색체 교차(chiasma)의 빈도수 제한이 없어 원형(wild type)에서도 유전적 변이가 일어날 확률이 높아진다는 것을 의미한다(Zhang et al., 2008). 인공 염색체 절단의 빈도수와 특정부위에서 일어날 경우 비정상적인 이가 염색체가 형성되는 것도 확인하였다(Fig. 3E). 이러한 현상은 두 Leymus 염색체 사이에서 뿐만 아니라 L. mollis 염색체와 밀 염색체 사이에서도 일어나는 것을 확인하였으며, 이는 인공 염색체 절단과 결합이 무작위로 일어나는 것을 의미한다고 할 수 있다(Fig. 3F). 이러한 인공 염색체 절단에 의한 염색체 조합의 빈도수는 무처리구에 비하여 증가하였다(Table 2).
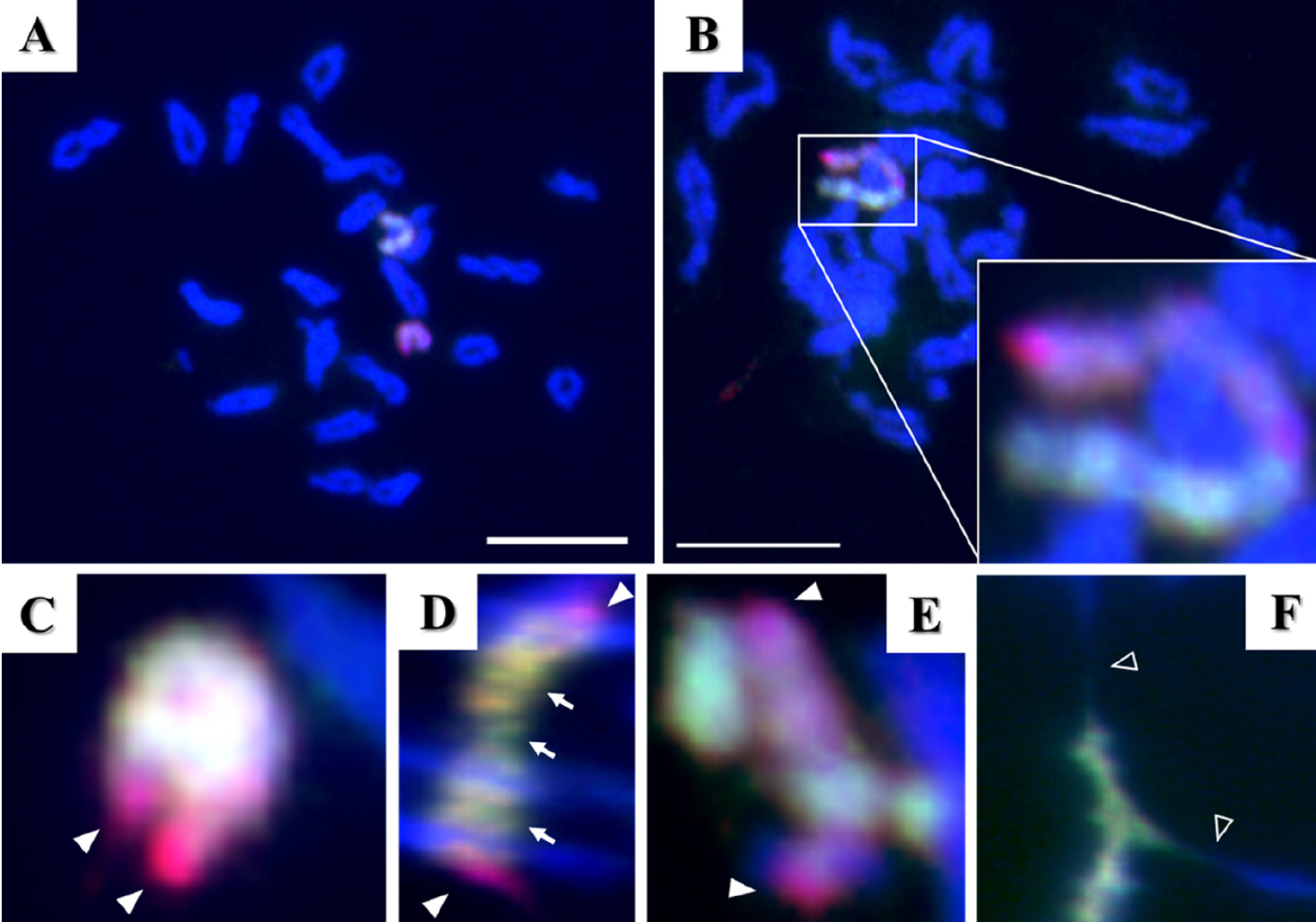
Fig. 3.
Chromosomal rearrangement by chromosome breakage during diakinesis. Univalents of alien chromosomes in the wheat genetic background (A); bivalents with abnormal structures by partial chromosome rearrangement by chromosome breakage (B & C); an alien bivalent with a normal structure (D) or an abnormal structure (E) in the wheat genetic background; and fused chromosomes between alien and wheat chromosomes (F). Each arrowhead indicates each telomeric region, and each empty arrowhead indicates the fused part between wheat chromosomes and Leymus mollis chromosomes. Each arrow in D indicates an overlapped chromosome region between two Leymus chromosomes. Scale bar, 10 µm.
보통의 이중 일가 외래 염색체 첨가 계통에서 생식세포분열 중기(metaphase I)의 각각의 Leymus 일가 염색체는 Cho et al. (2011b)의 보고에 의하면 적도판(equational plate)을 기준으로 수직(vertical-) 및 수평 위치(horizontal position)를 이루고 있다(Fig. 4A and B). 제부라린을 처리한 이중 일가 외래 염색체 첨가 계통에서는 보통 밀의 이가 염색체 형태인 막대(rod)형태가 확인되었다(Fig. 4C). 보통 밀의 이가 염색체는 염색체 교차 빈도와 일어나는 부위에 따라 원(ring), 막대(rod), 그리고 후라이팬(frying pan) 모양의 형태를 이루고 있다. 하지만 두 Leymus 염색체의 말단의 이질염색질 부분을 제외한 전장에서 염색체 결합이 이루어진 이가 염색체는 전장에 걸쳐 염색체 결합을 이루어져 있기 때문에 보통 밀의 이가 염색체와 전혀 다른 형태를 이루고 있다(Fig. 4D). 이러한 형태에서 변형되어 완벽하게 겹친(overlap) 염색체도 확인하였다(Fig. 4E-G). L. mollis의 초록 형광 신호(green fluorescence)과 L. racemosus의 빨강 형광 신호(red fluorescence)이기 때문에 두 Leymus 염색체가 완벽하게 겹치면 이러한 현상이 일어날 수 있다. 하지만 이러한 현상은 최종적으로 사분자(tetrad) 시기에 영향을 미치지는 못하였다. 일반적으로 상동 염색체면 정확한 감수분열이 이루어져 사분자의 각 포자(spore)에 자매 염색분체(sister chromatid)가 분포한다(Cho et al., 2011b). Cho et al. (2011b)의 보고에 의하면 이중 일가 외래 염색체 첨가 밀 계통의 두 Leymus 염색체 간의 상동성을 나타내는 상동지수가 0.62로 확인되었다. 이 연구에서 제부라린을 처리한 이중 일가 외래 염색체 첨가계통의 상동지수는 0.61로 보통의 이중 일가 외래 염색체의 두 Leymus의 자매 염색분체 분포 비율과 큰 차이가 없었다(Table 2). 하지만, 보통의 이중 일가 외래 염색체 첨가계통에서는 그 외의 경우, 즉 이상한 염색체 분포가 나타나지 않았지만 제부라린을 처리한 이중 일가 외래 염색체 첨가계통의 경우에는 이상한 염색체 분포인 그 외(other in Table 2)의 빈도수가 증가한 결과로 보아 이가 염색체의 정상적인 형태를 갖추지 못한 Leymus 염색체들이 정상적인 염색체 분리가 일어나지 않아 정상적인 자매 염색분체로써 형태를 갖추지 못하여 이러한 현상이 일어나는 것으로 생각한다.
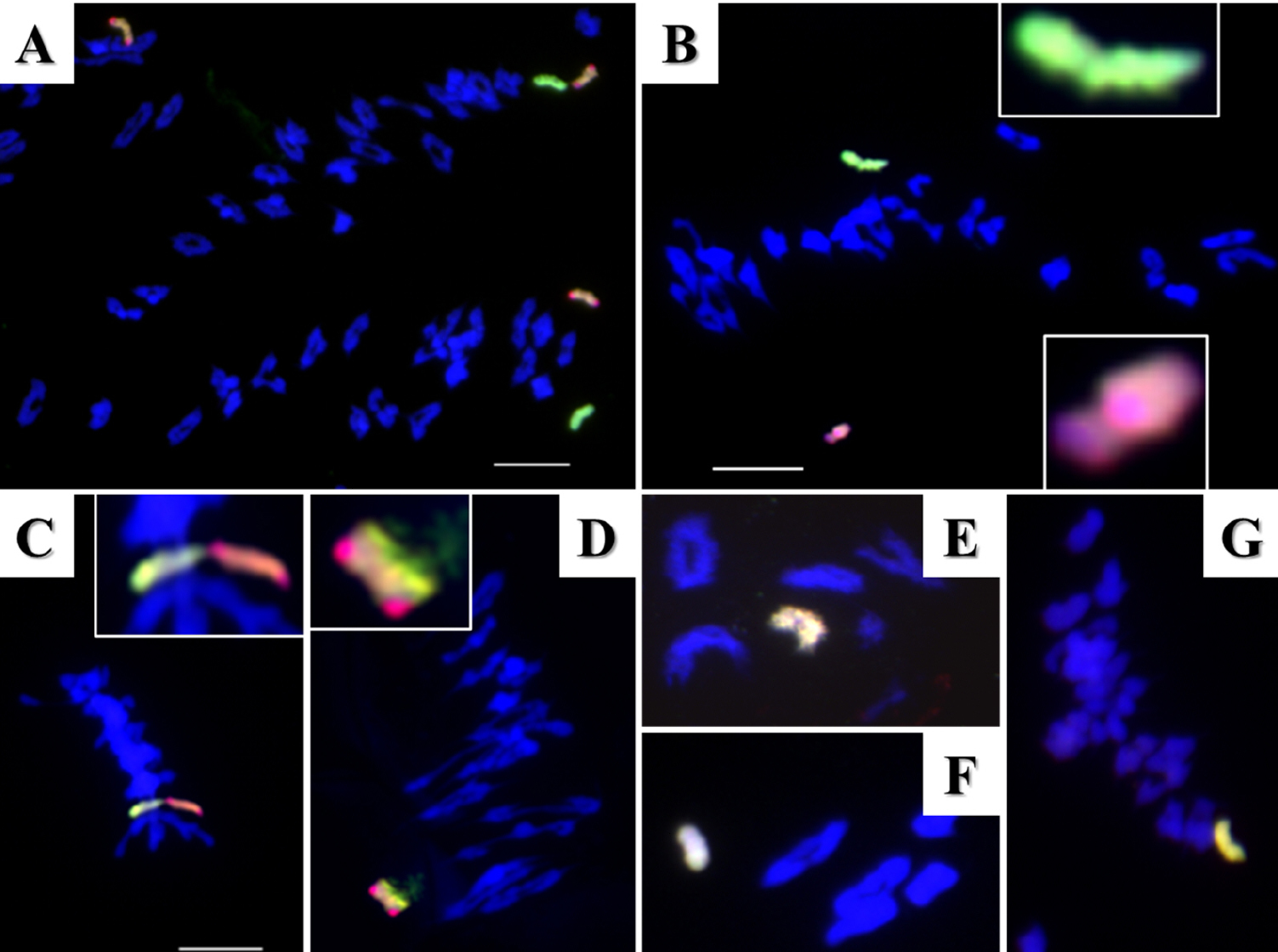
Fig. 4.
Investigation of bivalents between homoeologous chromosomes by chromosome breakage in the wheat genetic background during the first metaphase. Alien univalents in the wheat genetic background (A); alien univalents with abnormal structures such as gaps and folding (B); an alien bivalent with fusion in the whole chromosome region (C) or at the distal end of each chromosome (D). Scale bar, 10 µm.
Table 2.
Comparison of the frequency of chromosome association during late prophase and coefficient of homology (h) in accordance with the distribution ratio of L. mollis (L.m) and L. racemosus (L.r) chromosomes in a tetrad spore because of the effects of zebularine on meiosis.
적 요
이 연구에서는 인공 염색체 절단의 유발원인 제부라린을 두 종류의 Leymus 염색체가 첨가된 이중 일가 외래 염색체 첨가 밀 계통의 생식세포 분열기에 처리함으로써 인공 염색체 절단이 상동성이 결여된 외래 염색체 사이의 염색체 조합에 미치는 영향을 확인하고자 수행하였다. 밀의 유전적 배경에서 두 외래 염색체의 행동은 genomic in situ hybridization을 이용하여 확인하였다. 결과적으로 생식세포 분열 전기 초반에 인공 염색체 절단은 두 외래 염색체의 핵형 차이인 말단의 이질염색질을 제외한 전장에서 발생하였으며, 그로 인하여 염색체 융합이 이루어져 이가 외래 염색체의 형태가 형성되는 것을 확인하였다. 이처럼 제부라린 처리에 의한 인공 염색체 절단이 체세포분열(mitosis) 염색체뿐만 아니라 생식세포분열 염색체에 염색체 접합과 유사한 현상을 유발시키는 것을 확인하였으며, 이를 통하여 상동성을 엄격하게 조절하는 Ph1 유전자를 가지고 있는 밀의 유전적 배경에서 동조 또는 비상동 관계에 있는 염색체 사이에서 염색체 결합이 이룰 수 있는 것을 확인하였다. 반면, 인공 염색체 절단은 두 외래 염색체의 소실과 일반적인 이가 염색체의 형태가 아닌 비정상적인 형태의 외래 이가 염색체도 유발하는 것을 확인하였다. 이러한 현상은 보통 형태와 유사한 이가 외래 염색체가 형성되었음에도 불구하고 생식세포 분열의 사분자의 포자에 자매염색분체의 분포 비율에 부정적인 영향을 미침으로써 염색체 조합의 빈도를 나타내는 상동성 지수에 유의미한 차이를 나타내지 못했다. 따라서 인공 염색체 절단에 의한 염색체 결합의 빈도와 발생부위에 대한 조절을 작물학적 관점에서 이용하려면 앞으로 지속적인 염색체 연구를 바탕으로 좀 더 구체적이고 세밀한 제부라린의 투여량, 처리시간 및 처리방법에 대한 연구가 필요할 것으로 생각한다.





