서 론
재료 및 방법
식물 재료
발아 특성 검정
연관 지도(Linkage map) 작성과 QTL 분석
통계분석
결과 및 고찰
양친과 RIL 집단의 발아특성
저온발아성 및 발아속도 QTL 분석
QTL 조합에 따른 저온 스트레스 내성의 변화
적 요
서 론
벼(Oryza sativa L.)는 세계 인구의 절반 이상이 주식으로 하는 매우 중요한 작물로써, 단위 면적당 생산력이 높아 급증하는 세계 인구의 식량 작물로 중요성이 높아지고 있다. 벼는 주로 이앙재배법으로 재배되고 있으나, 최근 노동력 감소 및 재배 비용 절감을 위해 직파재배법이 증가하는 추세이다. 하지만 직파재배는 육묘과정없이 바로 노지에 파종 되기 때문에 발아 단계에서의 저온 및 담수로 인한 산소 부족 등 다양한 스트레스에 노출되어 발아 및 입모의 불안정을 초래한다.
벼는 열대가 원산지인 작물로 밀이나 보리 등 다른 화본과 작물에 비해 저온에 매우 민감한 편이며(Ye et al., 2009), 우리나라를 포함한 동북아시아 온대 지역과 고위도 지역의 벼 생산국가에서 저온 스트레스는 벼의 안정적인 생산에 악영향을 미친다. 우리나라 직파 재배의 파종 시기는 대체로 4월 중순 이후로 이 시기에 파종 된 종자는 노지의 저온 상태에서 발아 과정을 거치게 되며 벼 종자는 저온과 저산소 조건의 불량한경에서 발아해야 하기때문에 정상적인 발아가 힘들다. 따라서 직파재배에서 저온 스트레스는 혐기 스트레스와 함께 균일한 발아와 안정적 입모를 저해하는 요소 중 하나이다.
저온 스트레스는 벼의 전 생육단계에서 영향을 주지만, 특히 발아 단계에서의 저온 스트레스는 유묘의 활력과 성장율을 낮추며, 이삭의 발달을 억제하고 불임율을 높여 벼의 성장에 불리한 것으로 보고되고 있다(Jiang et al., 2020). 벼 직파 재배 시 저온 스트레스는 발생 시기 및 빈도의 예측이 어렵고, 벼 파종 시기에 따라 피해 양상과 발생 요인이 다양하기 때문에 재배적인 방법만으로는 적극적인 대처가 힘들다. 저온에서의 안정적인 발아와 빠른 발아 속도는 벼의 초기 생육을 결정 짓고 불량한 환경에서의 적응력을 높이는 중요한 특성으로 직파재배 품종의 안정적인 초기 입모를 위해서는 반드시 필요한 형질이다(Jeong et al., 2019; Najeeb et al., 2020). 따라서 직파 재배시 안정적인 초기 입모 확보를 위해서는 저온에서도 발아력이 높고 발아속도가 빠른 품종을 육성하는 것이 가장 효과적인 방법이다.
현재까지 저온발아와 관련하여 거의 모든 염색체에서 다수의 QTL이 확인되었으나(Redoña & Mackill, 1996; Suh et al., 2010; Miura et al., 2001; Teng et al., 2001; Fujino et al., 2004; Hou et al., 2004; Han et al., 2006; Jiang et al., 2006; Lin et al., 2011; Najeeb et al., 2020), 이들 중 소수의 QTL만이 클로닝되어 기능이 보고되었다. 최근 보고 된, OsSAP16는 저온에서의 발아를 조절하는 유전자 중 하나로써 OsSAP16의 발현은 발아 중 필요한 단백질의 양의 조절하여 저온에서의 발아를 촉진하는 것으로 보고되어 있다(Wang et al., 2018). 이전에 보고 된 qLTG3-1는 배아를 덮는 조직을 약화시키는 기능을 하여 초엽의 신장으로 조기 발아를 유도에 관여하지만 저온에 특이적이지 않다(Fujino et al., 2008).
저온내성 개선을 위한 연구는 환경적 요인의 불일치, 온실 실험과 포장 실험에 대한 결과의 차이 그리고 적절한 유전자원의 부족 등의 이유로 아직까지 그 기작이 완전히 밝혀지지 않았다(Jiang et al., 2020; Fujino et al., 2008). 현재 저온에서의 발아 기작에 관한 연구는 주로 저온발아율에 집중되어 있으며, 환경 적응력을 높여주는 발아 속도에 관한 연구는 거의 보고된 바 없다. 저온으로 인해 파종 이후 발아까지의 기간이 길어지면 종자의 부패 등으로 입모율(Anaerobic germination)이 낮아지며(Ko et al., 2011), 생육이 불량하기 때문에 직파재배 시 안정적인 입모를 형성 하는 데에는 저온에서의 균일한 발아와 높은 발아속도가 매우 중요한 특성으로 보고되고 있다(Jiang et al., 2004; Wang et al., 2016). 따라서 저온에서의 안정적인 벼 재배를 위해서는 저온에서의 높은 발아율 뿐만 아니라 발아 속도에 관한 연구가 필요하다.
본 연구는 ‘밀양23호’와 저온 발아성이 강한 것으로 보고된 ‘기호벼’의 교배를 통해 육성된 자식성재조합집단을 이용하여 저온발아율과 발아속도에 연관된 QTL을 탐색하고, 저온 스트레스 내성 품종 육성을 위한 육종 소재로서의 이용 가능성을 검토하였다.
재료 및 방법
식물 재료
저온에서의 발아율 및 발아속도와 연관된 QTL 탐색을 위하여 저온 발아성이 약한 통일형 품종 ‘밀양23호’를 모본으로, 저온발아성이 양호한 자포니카 ‘기호벼’를 부본으로 인공교배하여 육성된 자식성 재조합 집단(RIL; Recombinant Inbred Line)을 식물 재료로 사용하였다. 이 RIL 집단은 1988년도에 교배되어, F2를 자식하여 확보한 종자를 일주일계통법(Single Seed Descent method)을 이용하여 F6 세대까지 육성하였으며, 이 후 F7 세대부터는 일계통 일종자법을 통해 25세대 이상 고정된 집단이다(Ji et al., 2012). 모․부본과 RIL 집단은 2017년에 국립식량과학원에 소재한 벼 시험 포장(전라북도 완주군)에서 표준재배법으로 재배한 후 종자를 수확하였다. 수확 후 종자는 활력 유지를 위해 수분함량을 15% 정도가 되도록 건조하고, 이후 4°C 저온 저장고에 보관하였다. RIL 계통 간 발아 특성 조사 시 실험 오차를 최소화하기 위해 발아적온(30°C)에서 사전 발아율 검정을 통해 종자 발아율이 80% 미만인 계통을 제외하고, 발아가 안정인 129계통을 본 연구의 시험 재료로 사용하였다.
발아 특성 검정
모부본과 RIL 집단의 발아특성 평가는 실내에서 항온기(DAEYANG; Korea)를 사용하여 저온(13°C)과 상온(30°C)에서 각각 온도차이에 따른 종자의 발아특성을 비교하였다. 종자의 발아특성을 평가하기 위한 대표 형질로 발아율과 발아속도를 조사하였다. 발아특성 검정은 충실한 종자 100립을 거름종이 2장이 깔린 직경 9 cm 크기의 petri-dish에 균등하게 치상 한 후, 증류수 30 ml을 첨가하여 물 위에 뜨는 종자가 없도록 바닥에 가라앉혔다. 이후 petri-dish를 상온과 저온으로 조절된 항온기에 옮긴 후 상온조건은 치상 후 7일간, 저온조건은 14일간 실시하였으며 24시간 간격으로 발아한 종자수를 조사하였다. 종자 발아율(PG: Percent of Germination)은 공시한 종자수에 대해 검정 기간 동안 발아한 전체 종자수를 백분율로 계산하였다. 종자의 발아속도는 발아속도계수(GCV: Germination Coefficient of Velocity)를 사용하여 계산하였다. GCV는 평균발아일수(MGT: Mean Germination Time)의 역수 값으로 GCV는 값이 클수록 평균발아일수가 짧아지게 되어 발아속도가 빠름을 의미한다. 예를 들어 조사 첫째 날 모든 종자가 발아할 경우 GCV 값은 100이 된다(Shon et al., 2014).
PG = (N/S) × 100
(PG: 발아율, N: 총 발아 종자수, S: 총 공시 종자수)
GCV = [N/∑(TiNi)]
(GCV: 발아속도계수, Ti: 치상 후 조사일수, Ni: 조사당일 발아종자수, N: 총 발아 종자수)
연관 지도(Linkage map) 작성과 QTL 분석
RIL 각 계통의 유전자형은 SSR (Simple Sequence Repeat) 마커와 SNP 칩(Illumina BeadXpress 384-plex SNP plate GS0011861, Illumina, San Diego, CA, USA)을 이용하였다. 식물 재료의 DNA 추출은 파종 후 약 20일에 어린잎을 채취한 후 DNeasy Plant Mini Kit (QIAGEN, Germany)를 이용하였다. SSR 마커 분석을 위해 전체 671개의 마커에 대해 양친에 다형성 검정을 실시하고, 이중 다형성을 보이는 424개 마커를 선별하여 RIL 집단의 유전자형 분석을 진행하였다. PCR 반응은 25 ng의 DNA template, Primer 10 µM, KCI 50 mM, MgCl2 1.5 mM, 그리고 0.5U의 Taq polymerase를 이용하여 총 20 µl의 PCR solution으로 실시하였다. GeneTouch (BIOER, China)를 사용하여, 95°C에서 8분간 초기 변성 후, 94°C에서 30초, 55°C에서 30초, 72°C에서 1분으로 총 35 cycle 반복한 후, 마지막으로 72°C에서 10분 반응하였다. PCR 산물은 수직 전기영동 장치(Nihon Eido Co. NA-1114)에서 natural acrylamide gel (8%)을 이용하여 전기영동 한 후, Silver staining (SILVER SEQUENCETM Staining Reagent Kit, Promega)로 염색하여 다형성을 확인하였다. SNP 유전형분석은 BeadXpress (Illumina®)을 이용하였다. 분석은 Vera Code manual protocol (Illumina, San Diego, CA, USA)의 방법에 따라 실시하고, Illumina BeadXpress Reader와 ALCHEMY software을 이용하여 유전자형을 분석하였다(Wright et al., 2010).
연관지도의 작성은 MAPMAKER/EXP 3.0을 이용하였으며 유전적 거리는 산출은 Kosambi 함수식을 적용하였다(Lincoln et al., 1993). SSR 마커와 SNP 마커 중 결측치가 높거나(15% 이상) 염색체상 위치가 중복되는 마커는 제외하고 327개의 마커를(168 SSRs와 159 SNPs) 최종 연관지도 작성에 이용하였다.
발아율 및 발아속도에 대한 QTL 분석은 IciMapping Version 4.1 프로그램을 이용하여 CIM (Composite Interval Mapping) 방법으로 수행하였다(Zhang et al., 2008). 유의한 QTL을 확인하기 위하여 발아관련 형질들과 전 유전체상의 유전자형에 대하여 1000-permutation test를 통해 p ≤ 0.05 수준에서 QTL 분석을 실시하였다.
통계분석
발아 관련 형질의 모․부본간의 차이에 관한 통계 분석은 SAS 프로그램(Version 9.4, Enterprise Guide 7.1, SAS Institute Inc, Cary, NC, USA)을 이용하여 T-검정을 통해 유의성 검정을 실시하였으며, 종자 발아의 상온 및 저온에서 형질들 간 상관관계 분석을 실시하였다. 저온발아특성 간의 QTL 조합에 따른 계통의 저온 스트레스 내성 및 담수발아와 저온발아 QTL의 조합에 따른 담수 입모율의 특성 변화 분석은 Duncan의 다중범위검정(Duncant’s multiple range test)을 이용하여 분석을 실시하였다.
결과 및 고찰
양친과 RIL 집단의 발아특성
상온조건에서 ‘밀양23호’와 ‘기호벼’의 발아율은 각각 100%로 모두 정상 발아하였다. 저온조건에서 발아율(LTG; Low temperature germination)은 ‘밀양23호’가 48.7%, ‘기호벼’가 76.0%로 ‘기호벼’가 ‘밀양23호’보다 저온발아율이 높게 나타났다(Table 1, Fig. 1a).
Table 1.
Phenotypic data of seed germination characteristics among parent and RIL population.
| Traits | OTG (%) | LTG (%) | OGCV | LGCV | |
| Parents | Milyang23 | 100±0.0 | 48.7±1.5 | 54.2±5.8 | 8.9±0.39 |
| Gihobyeo | 100±0.0 | 76.0±3.6* | 68.0±6.9* | 9.1±0.59 | |
| RILs | Mean | 96.6 | 34.1 | 45.5 | 9.2 |
| Range | 80-100 | 0.0-95.3 | 22.8-79.6 | 7.1-14.3 | |
| Skewness | -1.81 | 0.45 | 0.22 | 1.20 | |
| Kurtosis | 2.44 | -0.81 | 0.02 | 1.93 | |
| CV (%) | 4.5 | 79.8 | 24.1 | 13.5 |
발아속도는 상온에서(OGCV; Germination Coefficient of Velocity under Optimal condition) ‘밀양23호’가 54.2, ‘기호벼’가 68.0으로 ‘기호벼’의 발아속도가 ‘밀양23호’보다 빠른 것으로 조사되었다. 저온조건에서 발아속도(LGCV; Germination Coefficient of Velocity under Low Temperature condition)는 ‘밀양23호’와 ‘기호벼’가 각각 8.9와 9.1로 비슷한 경향으로 나타내었으며 저온조건에서는 ‘밀양23호’와 ‘기호벼’는 발아속도는 통계적으로 차이가 없는 것으로 분석되었다(Table 1, Fig. 1b).
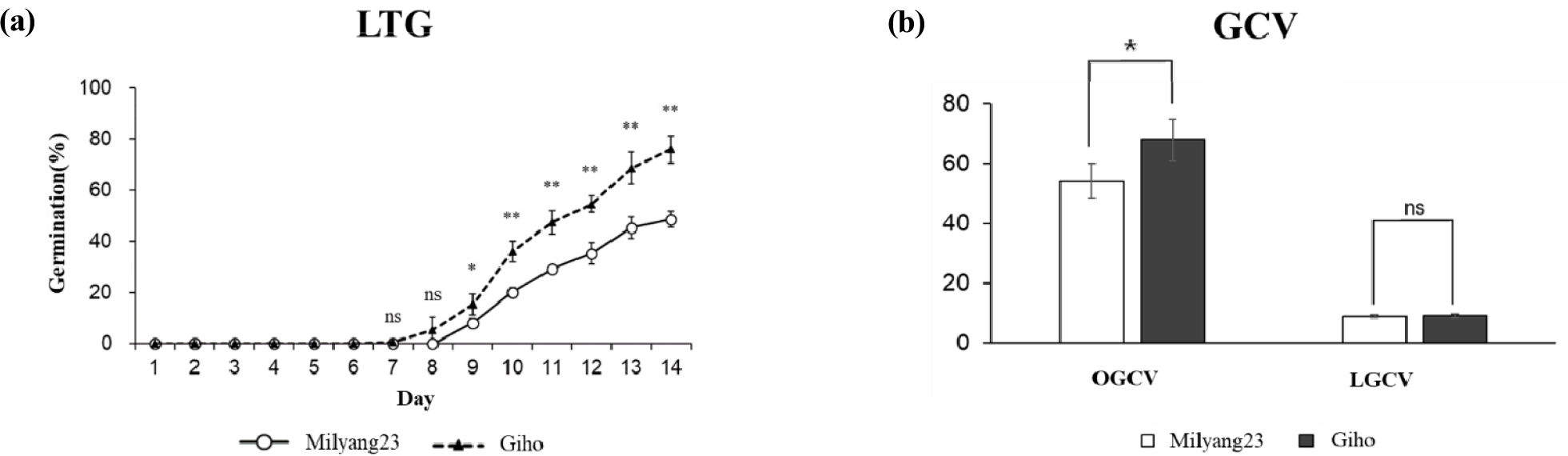
Fig. 1.
Comparison of germination rate and germination coefficient of velocity (GCV) between two parents (a) Changes in germination rate of two parents during 14 days under low-temperature conditions (13°C). The open circles and black triangles represent the cumulative germination rates of the ‘Milyang23’ and ‘Gihobyeo’ at survey days, respectively. (b) Comparison of GCV of two parents under 30°C (OGCV) and 13°C (LGCV) conditions. * and ** significant difference at p < 0.05 and p < 0.01 by t-test.
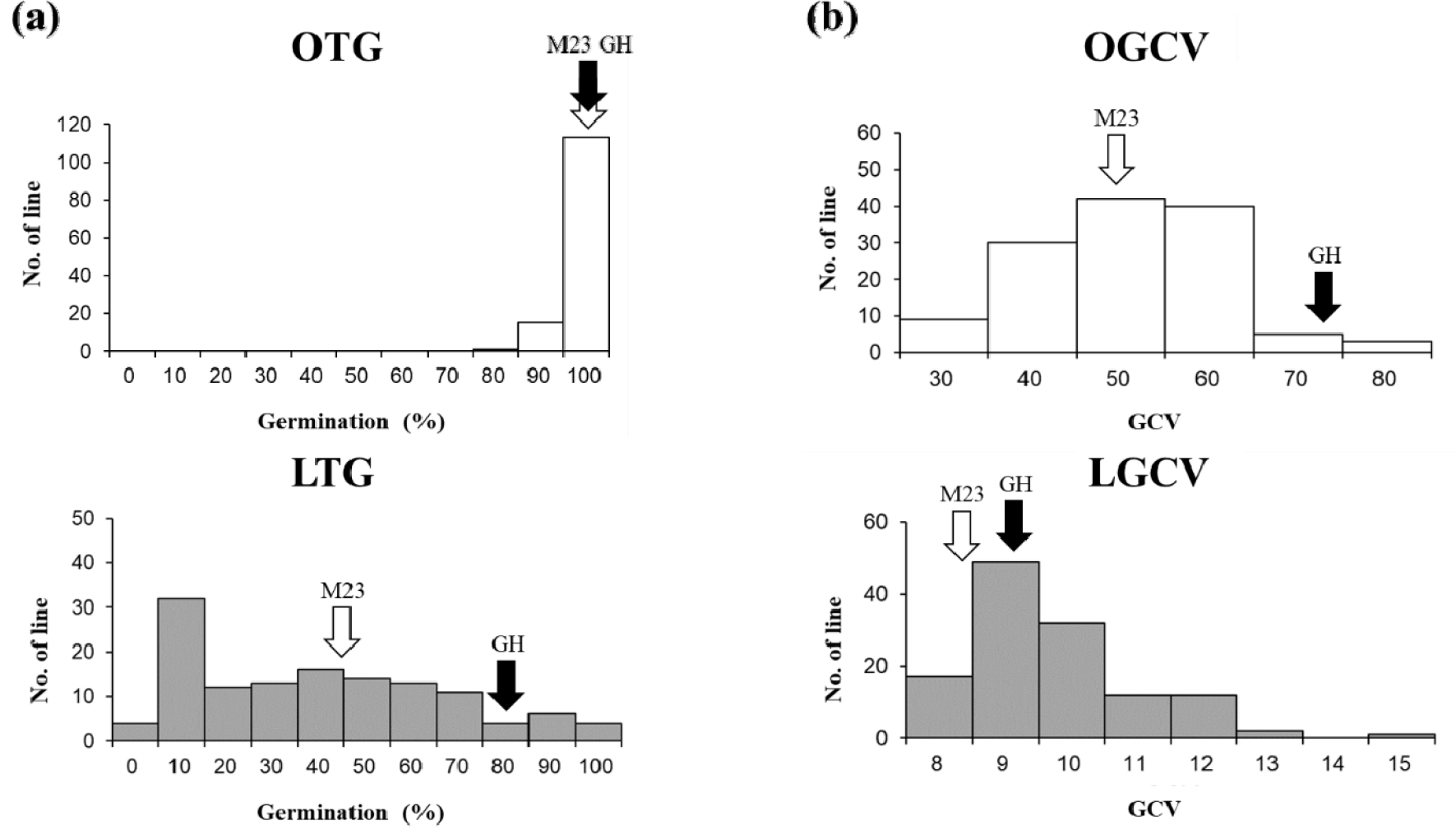
RIL 집단의 온도차이에 따른 발아율 및 발아속도 변이 분포는 Table 1과 Fig. 2와 같다. 상온에서 RIL 집단의 평균 발아율은 96.6%, 범위는 80-100%이며, 저온에서 평균 발아율은 34.1%, 범위는 0-95.3%로 ‘밀양23호’ 쪽으로 치우친 분포(왜도 = -1.81, 첨도 = 2.44)를 보였다(Table 1, Fig. 2a).
상온 및 저온조건에서 RIL 집단의 평균 GCV는 각각 45.5와 9.2으로 저온에서 발아속도가 감소되었으며, GCV 분포는 각각 22.8-79.6, 7.1-14.3였다. 상온조건에서는 정규분포(왜도 = 0.22, 첨도 = 0.02)와 유사한 분포를 나타내었으나, 저온조건에서는 발아속도가 늦어지는 쪽으로 치우치는 분포를(왜도 = 1.20, 첨도 = 1.93) 나타내었다(Table 1, Fig. 2b). 129개 RIL 계통 중 31개의 계통은 저온에서의 발아율과 발아속도가 부본인 ‘기호벼’보다 높아 초월분리하는 것으로 조사되었다.
저온발아성 및 발아속도 QTL 분석
총 327개의 마커(168 SSRs, 159 SNPs)를 이용하여 연관지도를 작성하였다. 유전자 지도의 전체 길이는 1564.0cM이고 마커 간 평균 거리는 4.8cM로 계산되었다(Table 2).
Table 2.
Summary of the molecular markers used for linkage map construction.
| Chr. |
Total no. of DNA markers |
No. of polymorphic markers |
Polymorphism (%) |
No. of markers used for linkage map constructionz |
Lengthy (cM)y |
Avg. distance (cM)x | ||||
| SSR | SNP | SSR | SNP | SSR | SNP | SSR | SNP | |||
| 1 | 83 | 44 | 63 | 34 | 75.9 | 77.3 | 16 | 20 | 190.0 | 5.3 |
| 2 | 80 | 37 | 32 | 32 | 40.0 | 86.5 | 19 | 15 | 159.0 | 4.7 |
| 3 | 68 | 41 | 43 | 23 | 63.2 | 56.1 | 21 | 19 | 182.5 | 4.6 |
| 4 | 50 | 35 | 28 | 20 | 56.0 | 57.1 | 12 | 10 | 138.4 | 6.3 |
| 5 | 72 | 28 | 28 | 13 | 38.9 | 46.4 | 11 | 8 | 137.3 | 7.2 |
| 6 | 36 | 35 | 27 | 20 | 75.0 | 57.1 | 10 | 16 | 110.3 | 4.2 |
| 7 | 44 | 30 | 37 | 26 | 84.1 | 86.7 | 12 | 18 | 120.9 | 4.0 |
| 8 | 54 | 29 | 41 | 21 | 75.9 | 72.4 | 15 | 11 | 137.8 | 5.3 |
| 9 | 40 | 23 | 36 | 18 | 90.0 | 78.3 | 14 | 12 | 85.4 | 3.3 |
| 10 | 38 | 24 | 26 | 14 | 68.4 | 58.3 | 9 | 11 | 75.1 | 3.8 |
| 11 | 53 | 30 | 34 | 18 | 64.2 | 60.0 | 16 | 11 | 108.3 | 4.0 |
| 12 | 53 | 28 | 29 | 15 | 54.7 | 53.6 | 13 | 8 | 119.0 | 5.7 |
|
Total (average) | 671 | 384 | 424 | 254 | (65.5) | (65.8) | 168 | 159 | 1,564.0 | (4.8) |
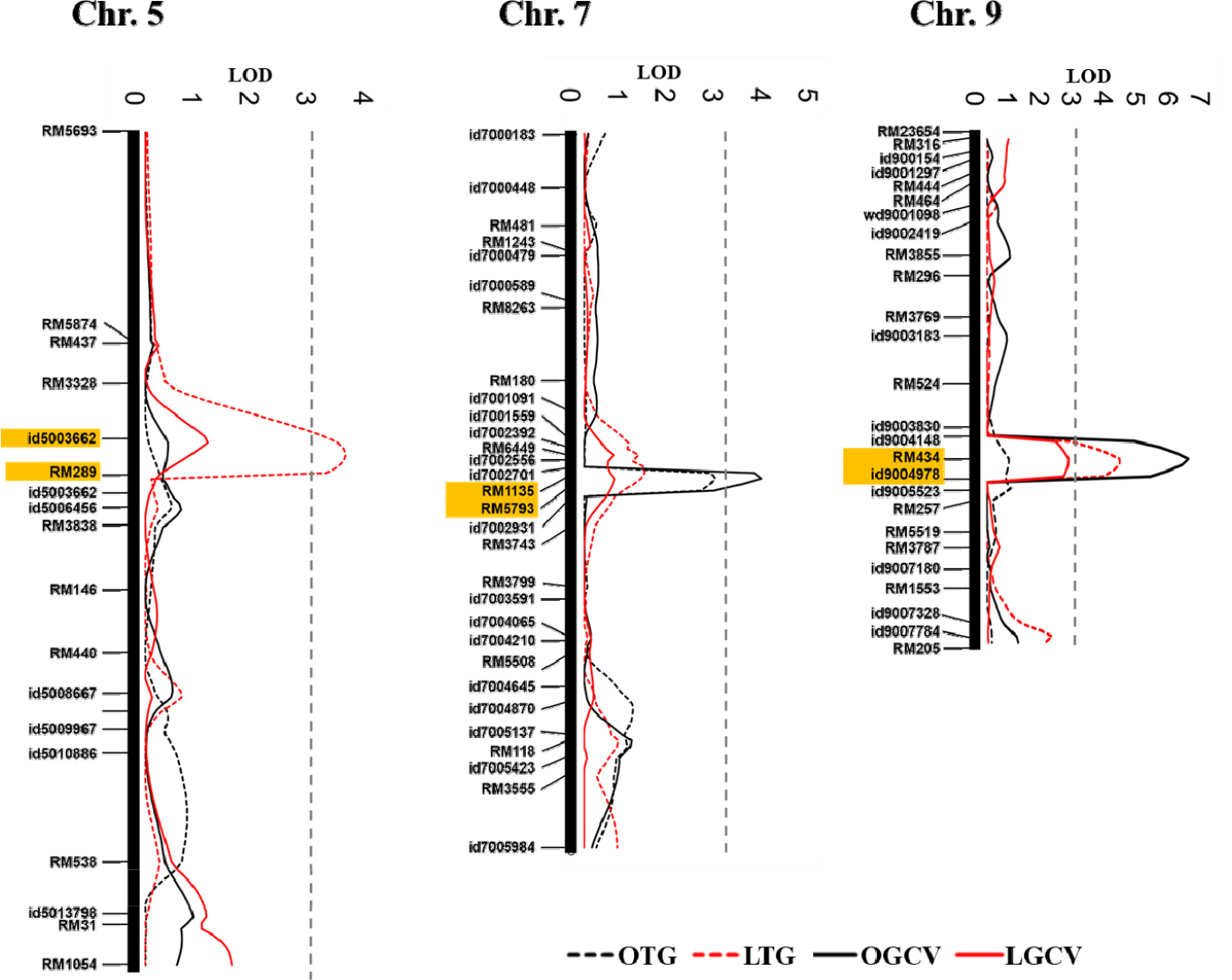
저온발아율에 대한 QTL 분석결과 5번, 9번 염색체상에서 2개의 QTL (qLTG5, qLTG9)가 탐색 되었다(Table 3). 두개 QTL의 LOD 값은 각각 3.51과 4.13이였으며, 저온발아 관련 QTL에 의해 설명되는 표현형의 변이는 각각 11.5%, 12.5%를 설명하였다. qLTG5, qLTG9는 모두 ‘기호벼’의 대립인자에 의하여 저온발아율을 증가되는 것으로 나타났다. qLTG5는 id5003662 (7.25 Mbp)와 RM289 (7.80 Mbp)의 사이에서, qLTG9는 RM434 (15.66)와 id9004978 (16.97 Mbp)의 사이에서 탐색 되었다. 최근까지 자포니카 유래 저온발아 관련 QTL이 다수 보고되고 있다(Miura et al., 2001; Teng et al., 2001; Najeeb et al., 2020). Miura et al. (2001)은 자포니카 품종 ‘Nipponbare’에서 유래한 저온발아 QTL을 4, 5번 염색체에서 보고하였으며, Teng et al. (2001)은 자포니카 품종 ‘JX17’ 유래 저온발아 QTL을 4번과 9번 염색체에서 보고하였다. 최근 Najeeb et al. (2020)은 6K SNP chip를 이용한 유전 분석을 통하여 1, 5, 7번 염색체에서 저온발아 및 저온스트레스 관련 5개의 주요 QTL (LOD>7.0, 설명 가능한 표현형의 변이>15%)을 보고하였다. Redoña & Mackill (1996)은 4개의 초기 유묘 성장 QTL을 1, 4, 5, 9번 염색체에서 보고하였다. 또한 9번 염색체에는 벼의 초기 유묘 활력에 영향을 주는 유전자 α-아밀라아제 그룹(RAmy3A, RAmy3B, RAmy3C)이 분포하는 것으로 알려져 있다(Causse et al., 1994; Thomas et al., 1994).
Table 3.
QTL for germination rate identified from the Milyang23/Gihobyeo RIL population.
| Trait | QTL | Chr. | Flanking markers | CIM | ||||
| Left marker | Right marker | LODz | PVEy (%) | Addx | Positionw | |||
| LTG | qLTG5 | 5 | Id5003662 | RM289 | 3.51 | 11.51 | -8.75 | 57.5 |
| qLTG9 | 9 | RM434 | Id9004978 | 4.13 | 12.5 | -9.24 | 57.7 | |
종자의 상온에서의 발아속도에 대한 QTL 분석결과 7, 9번 염색체에서 2개의 QTLs (qOGCV7, qOGCV9)이 탐색 되었다(Table 4). QTL의 LOD 값은 각각 4.08과 6.18이였으며, 설명 가능한 표현형의 변이는 각각 9.8%, 15.0%였다. qOGCV7는 RM1135 (16.93 Mbp)와 RM5793 (17.49 Mbp)의 사이에서 qOGCV9는 RM434 (15.66 Mbp)와 id9004978 (16.97 Mbp) 영역에서 확인되었으며, qOGCV7와 qOGCV9는 각각 ‘밀양23호’와 ‘기호벼’ 대립인자에 의하여 발아속도가 증가하는 것으로 확인되었다. 저온조건에서의 발아속도에 대한 QTL 분석결과, 상온발아와 연관된 QTL인 qOGCV9와 동일한 위치에서 저온발아 속도와 연관된 QTL이 탐색되었으나 LOD 값은 2.56으로 그 값이 다소 낮았다(Fig. 3).
Table 4.
QTL for germination speed identified from the Milyang23/Gihobyeo RIL population
| Trait | QTL | Chr. | Flanking markers | CIM | ||||
| Left marker | Right marker | LODz | PVEy (%) | Addx | Positionw | |||
| OGCV | qOGCV7 | 7 | RM1135 | RM5793 | 4.08 | 9.8 | 0.04 | 60.0 |
| qOGCV9 | 9 | RM434 | Id9004978 | 6.18 | 15.0 | -0.05 | 57.7 | |
종자의 발아속도가 빠르면, 발아에 소요되는 일수가 짧아 발아가 균일하여(Alhamdam et al., 2011; Pradhan & Badola, 2012), 모의 안정적인 생육이 가능하기 때문에 안정적인 초기 입모를 위해서는 매우 중요한 특성이다. Li et al. (2013)은 저온발아(15°C)에 관한 QTL분석을 통하여 7, 9, 12번 염색체에서 3개의 QTL (qLTG-7, qLTG-9, qLTG-12)을 보고하였다. 이중 qLTG-9 (12.55-15.66 Mbp)는, 본 연구에서의 탐색된 상온발아속도(qOGCV9, 15.66-16.97 Mbp), 저온발아율(qLTG9, 15.66-16.97 Mbp), 저온발아속도와 연관된 QTL과 염색체상 위치가 유사하였다. Li et al. (2013)에 의하면 qLTG-9는 저온발아에 영향을 주는 안정적인 QTL로 보고되고 있는데, 본 연구의 qOGCV9 및 qLTG9 또한 저온에서 발아율 및 발아속도증가에 영향을 주는 것으로 분석되어 기존 연구결과와 유사하였다. Hou et al. (2004)은 저온발아 관련 주요 QTL에 대한 분석을 통하여 7번 염색체상에서, qLTG-7 (16.87-22.58 Mbp)을 보고하였으며, 이는 본 연구에서 탐색된 qOGCV7 (16.93-17.49 Mbp)와 중첩되었다. qOGCV7는 저온조건 조건에서는 탐색되지 않고 다만 상온조건에서 발아속도 증가에 관여하는 것으로 나타나 Hou et al. (2004)이 보고한 저온발아에 관련된 주요 QTL인 결과와는 차이가 있었다.
저온과 같은 비생물학적 스트레스(Abiotic stress)의 유전 및 표현형의 발현은 다양한 환경적 요인에 크게 영향을 받으며, 관련 특성은 다수의 QTL과 유전자 조합에 의해 좌우된다(Shakiba et al., 2017; Zhao et al., 2017). 따라서 저온에서의 다양한 특성 QTL과의 연관 분석은 저온 스트레스 내성을 향상시키는데 중요하다. 과거 다양한 집단을 이용하여 저온 스트레스에서의 발아, 속도, 유묘기, 수잉기 등에 관한 다양한 QTL 연구가 수행되었으며, 몇몇 연구에서 주요 QTL을 보고하였다(Andaya & Mackill, 2003; Fujino et al., 2004; Lou et al., 2007; Jiang et al., 2017; Shakiba et al., 2017). 그러나 저온발아와 발아속도의 상호작용 및 주요 QTL에 대한 연구보고는 거의 없다. 본 실험에서 확인된, qLTG9 (qOGCV9)은 자포니카 ‘기호벼’의 대립인자 유래로 저온발아 뿐만 아니라 발아속도에도 관여하는 것으로 확인되었으며, qOGCV7은 과거에 보고된 저온발아에 관련된 주요 QTL과 중첩하여 본 실험에서 확인된 QTL이 저온 스트레스 내성을 개선시키는데 유용하게 이용될 것으로 예상된다.
QTL 조합에 따른 저온 스트레스 내성의 변화
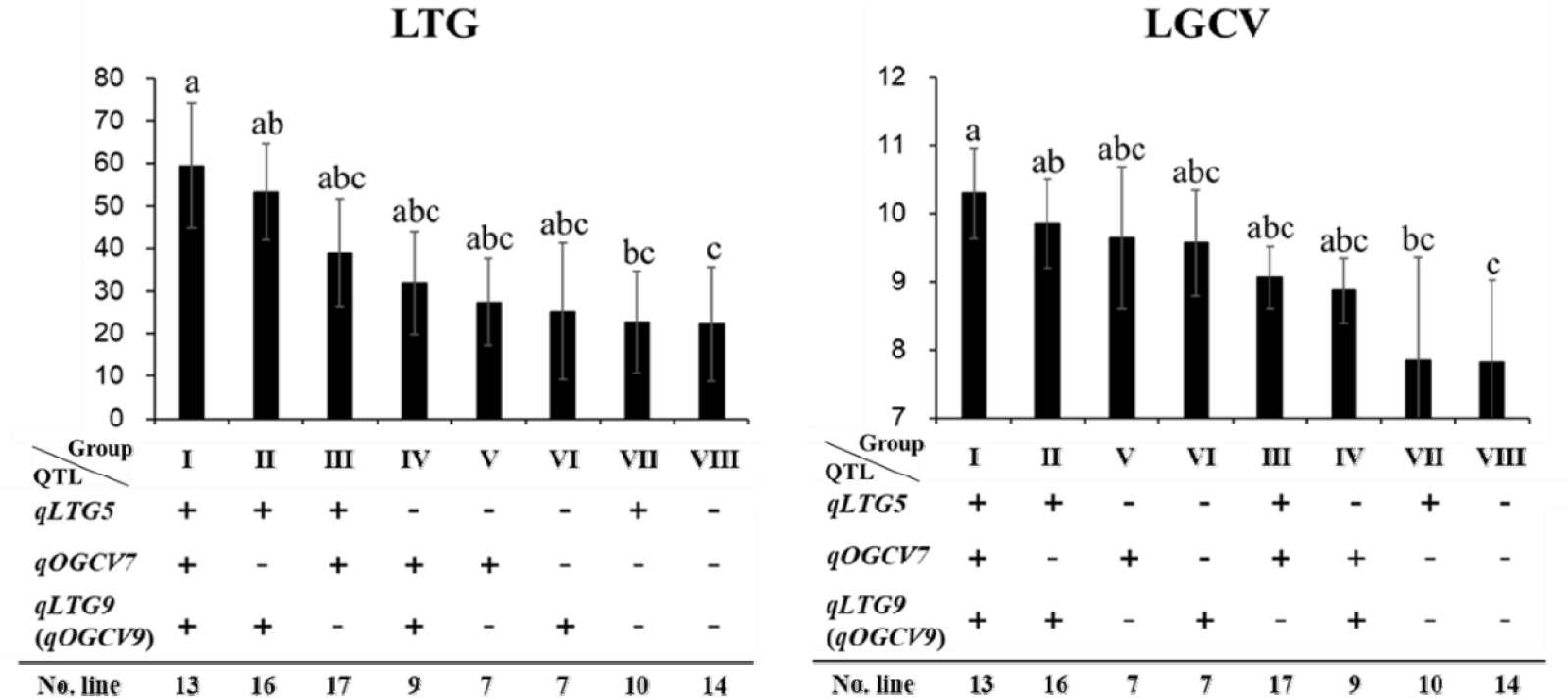
세개의 QTL의 유전자형과 저온 발아율 및 발아속도 사이의 관계에 기초하여 QTL의 조합에 따른 집적 효과를 확인하였다. 세개의 QTL의 유전자형에 집적 여부에 따라 129개의 RIL 집단을 8개의 그룹으로 분류하였다(Fig. 4). 저온발아에 대한 8개 그룹의 발아율은 22.28-59.44%의 분포를 나타내었으며, QTL을 보유 할 수록 저온 발아율이 향상되었다. Duncan 검정 결과 그룹Ⅲ, Ⅳ, Ⅴ, Ⅵ, Ⅶ의 저온 발아율은 그룹Ⅷ과 비교하여 저온 발아율의 개선에 유의한 차이가 없었으나, 그룹Ⅰ, Ⅱ의 저온 발아율 개선이 유의하게 높음을 확인하였다. 저온에서의 발아속도는 7.82-10.30의 분포로 나타났으며, 그룹Ⅰ, Ⅱ는 그룹Ⅷ과 비교하여 저온에서 발아속도를 개선시키는 데에 효과가 있는 것으로 확인되었으나 나머지 그룹Ⅲ, Ⅳ, Ⅴ, Ⅵ, Ⅶ은 그룹Ⅷ과 비교하여 통계적으로 유의한 차이가 없는 것으로 확인되었다. 저온조건에서의 발아율, 발아속도의 개선은 QTL을 모두 가진 계통들이 높은 것으로 확인되었다. 모본인 ‘밀양23’호는 상온발아속도관련 QTL(qOGCV7)을, 부본인 ‘기호벼’는 저온 및 상온발아속도관련 QTL[qLTG5, qLTG9 (qOGCV9)]을 보유하고 있었으며, 저온 스트레스에 대한 내성은 그룹Ⅱ [qLTG5+qLTG9 (qOGCV9)], 혹은 그룹Ⅰ [qLTG5+qOGCV7+ qLTG9 (qOGCV9)]의 계통들이 통계적으로도 유의하게 저온 스트레스에 대한 내성이 모두 증가 하는 것으로 확인 되었다.
벼의 직파재배 시 파종 후, 종자는 담수 및 노지상태에서 발아과정을 거치게 되어 저산소 및 저온 스트레스로 발아율이 떨어져 입모가 불안정하게 된다. 최근 Kim et al. (2019) 등이 밀양23호/기호 RIL 집단을 이용한 담수 발아 내성 QTL 분석을 통하여 담수 발아내성과 연관된 2개의 QTL (qAG2.1, qAG2.2) 보고하였다. 기존 보고된 혐기발아 내성 유전자위와 본 연구에서 탐색된 저온발아 연관 유전자위 조합에 따른 담수상태에서 입모율을 조사하였다. 저온 발아 관련 QTL과 담수 발아 관련 QTL의 보유 여부에 따라 RIL 집단은 4개의 그룹으로 분류되었다(Table 5). 저온발아(상온발아속도) 관련 QTL과 담수발아 관련 QTL을 모두 보유한 계통들(그룹A)의 담수환경에서의 입모율은 45.0%로 다른 그룹에 비해 입모율이 가장 높은 것으로 조사되었다. 담수발아 관련 QTL만을 보유하고 저온발아 관련 QTL을 보유하지 않은 계통들(그룹B)의 입모율은 35.0%로 담수발아 및 저온발아 QTL을 모두 보유한 계통들(그룹A) 보다는 낮은 입모율을 나타내었는데 이는 직파재배 환경에서의 안정적인 입모 확보를 위해서는 담수스트레스 내성 뿐만 아니라 및 저온발아와 관련된 특성도 담수직파 초기입모 확보를 위해서는 반드시 필요하다는 것을 보여준다(Table 5). 따라서 혐기 발아 내성 및 저산소 발아 내성 유전자가 조합된 중간모본의 육성은 향후 담수직파 품종 개발에 유용하게 이용될 것이다.
Table 5.
Germination rate and germination coefficient of velocity of the RILs with different allelic combinations of the QTLs.
|
LTG (OGCV) QTL combination |
AG QTL combination |
Germination rate and Germination coefficient of velocity |
Anaerobic germination | ||||||
| Group | qLTG5 | qOGCV7 | qLTG9 (qOGCV9) | qAG2.1 | qAG2.2 | No. Line | LTG (%) | LGCV | Survival rate (%) |
| A | + | + | + | + | + | 2 | 93.0a | 0.12a | 45.0a |
| B | - | - | - | + | + | 2 | 35.7b | 0.08ab | 35.0ab |
| C | + | + | + | - | - | 3 | 50.2ab | 0.09ab | 17.8bc |
| D | - | - | - | - | - | 2 | 2.3b* | 0.04b | 6.7c |
| MG RIL (n = 129) Mean | 34.1 | 0.09 | 27.3 | ||||||
양적형질은 (1) 다수 QTL의 조합 (2) 유전자좌 간의 상호작용 (3) 환경과의 상호작용에 의해 결정된다(Wade et al., 2001). 벼 품종 육성에서 QTL의 상호작용 및 pyramiding 효과는 목표 특성을 개선하고 향상 시키는 데에 매우 중요하다. 특히 QTL pyramiding은 목표 특성을 가진 계통의 선택을 용이하게 한다. 본 연구에서는 저온발아 및 발아속도 간의 상호작용을 분석하였으며, 담수발아내성까지 비교하여 최종적으로 5개의 계통을 유망한 유전자원으로 선발하였다. 선발된 계통은 자포니카 ‘기호벼’에서 유래된 것으로 원연교잡에 의한 불임, Linkage drag로 인한 열악 형질의 동반이 낮으며 저온 스트레스에 관한 QTL의 효과도 유지될 것으로 예상된다. 이러한 결과는 저온 및 담수 스트레스에서 내성을 개선하여, 향후 자포니카 직파 품종을 육성하는 데에 기여 할 것으로 기대된다.
적 요
자포니카 벼의 저온 스트레스 내성 증진을 위하여, RIL 계통을 이용하여 저온 스트레스 내성 QTL을 탐색하였다. 이를 통하여 (1) 5, 9번 염색체에서 저온발아에 관련한 ‘기호벼’ 유래 QTL, qLTG5와 qLTG9를 확인하였으며, 7, 9번 염색체에서 저온 발아속도에 관련한 ‘밀양23호’ 및 ‘기호벼’ 유래 QTL, qOGCV7, qOGCV9를 확인하였다. (2) Duncan 검정 결과, 그룹Ⅶ [qLTG5+qLTG9 (qOGCV9)], 그룹Ⅷ [qLTG5+ qOGCV7+qLTG9 (qOGCV9)]의 계통들이 저온 스트레스에 내성이 있는 것으로 확인 되었다. (3) 최근 발표된 RIL 집단 담수내성 계통과 비교한 결과, 저온 스트레스에도 내성이 있으면서 담수발아에도 내성이 있는 것으로 확인된 총 2개의 유망 유전자원을 선발하였다.
본 연구의 결과를 통해 저온 및 혐기 관련 QTL의 집적은 벼의 저온에서의 발아 및 초기 입모율을 높여 저온스트레스 내성 개선에 도움이 되는 것으로 판단 되었으며, 선발된 유망 계통은 향후 직파재배 품종 육성에 유용한 유전자원으로 활용되어 직파재배의 안정성 증대에 기여할 것으로 기대된다.