서언
재료 및 방법
가. 콩나물 배축 자색발현에 대한 품종간 차이 확인
나. 콩나물 재배 시 자색 발현 조건 구명
다. 콩나물 재배환경에 따른 자색발현에 대한 통계분석
결과 및 고찰
가. 콩나물 품종별 자색발현에 대한 유전적 영향
나. 콩나물 재배환경에 따른 자색발현에 대한 ANOVA 분석
다. 콩나물 재배환경에 따른 자색발현 정도
라. 콩나물 재배환경 상호관계에 따른 자색발현 정도
적요
서언
콩은 그 자체로 조리하여 섭취하기도 하지만 다양한 형태의 가공식품으로 이용되고 있다. 그 중, 가장 간편하고 경제적인 콩 가공방법은 콩을 발아시키는 방법이다. 콩은 발아 시 자엽에서 지질 함량은 감소하는 반면에, 루테인, β-카로틴, 클로로필 a의 함량은 증가한다. 이에 비해, 콩에 존재하지 않았던 비타민 C가 생합성되며 단백질과 전분의 소화율이 증가할 뿐 아니라 트립신 저해제, 피틴산과 같은 항영양인자의 함량이 낮아진다(Collins & Sand, 1976; Sathie et al., 1983; Mostafa et al., 1987; Lee et al., 2013). 따라서, 콩 발아식품인 콩나물은 소화율이 좋은 영양식품이라 할 수 있다. 또한 콩나물은 원료인 나물콩에 비해 이소플라본 함량이 높으며 숙취해소 효과를 보이는 아스파라긴산이 다량 함유되어 있다(Cho et al., 2009). 그리고 콩나물은 가격도 저렴하고 기호성이 높아 많이 이용되고 있으며, 재배기간이 짧고 사계절 내내 장소의 구분 없이 재배가 가능하며, 채소 생산이 불리한 겨울철에는 더욱 중요한 식품이다.
소비자의 기호에 맞는 콩나물을 생산하기 위해서는 기호 특성을 고려한 품질 평가가 이루어져야 하나 주로 콩나물의 외관, 즉 머리와 줄기 부분은 각각 노란색, 유백색을 띠고 잔뿌리가 없는 것이 좋은 품질의 콩나물로 평가되어 왔다(Park et al., 1995). 그러나 국내에서 개발된 콩나물 콩 품종에는 배축색과 꽃색이 자색(紫色)인 품종들이 다수 개발되었다. 최근까지 국내에서 개발된 178 품종 중 콩나물 콩 품종은 46 품종으로 이중 배축색과 꽃색이 자색(紫色)인 33 품종이 개발되었다(Lee et al., 2015a). 이들 품종은 콩나물 재배과정에서 배축과 자엽이 연결되는 부위에 콩나물 재배과정에서 자색의 발현으로 콩나물로써의 상품 가치를 하락시키는 요인들 중 하나로 여겨지고 있는 실정이다. 일반적으로 콩나물 재배실험 및 재배업자의 경험에 비추어 콩나물 배축의 자색발현은 재배온도와 관수온도간의 차이 및 광 노출에 기인된 것으로 추측할 수 있다. 그러나 자색발현에 관련된 요인들간의 과학적 상호관계는 밝혀져 있지 않은 실정이다.
숙주나물용 다선녹두는 암상태 숙주나물 재배과정에서 안토시아닌의 일종인 delphinidin-3-glucoside가 1.7 ㎍/g 이 함유된 것으로 보고된 바 있다(Kim et al., 2008). Kim et al. (2007)은 메밀싹 배축에 cyanidin 3-O-glucoside, cyanidin 3-O-rutinoside, cyanidin 3-O-galactoside, cyanidin 3-O-galactopyranosyl-rhamnoside이 함유된 것으로 보고하고 있다. 한편 콩을 토양 중에 재배할 경우 배축에는 3종류의 안토시아닌(delphinidin, petunidin, malvidin)이 생성된다는 보고(Peters et al., 1982)가 있다. 그러나 콩나물 품종에 대한 배축의 자색발현에 관련된 연구결과는 국내뿐만 아니라 국외에서도 발표된 바가 없다.
또한, 숙주나물 및 메밀싹 등에서 보고된 것을 종합할 경우, 품종에 따라 배축의 안토시아닌 발현이 차이가 나는 것으로 보아 콩나물 재배시에도 동일한 현상이 있을 것으로 추정할 수 있다. 이에 본 연구는 국내에서 육성된 자색배축을 나타내는 품종들의 콩나물 재배시 안토시아닌 발현을 조사하고 안토시아닌의 배축발현에 관련된 재배요인(재배온도, 관수온도, 재배기간)을 구명하여 자색배축 콩나물 품종을 콩나물 원료콩으로 확대하는데 필요한 기초자료를 제공하고자 하였다.
재료 및 방법
가. 콩나물 배축 자색발현에 대한 품종간 차이 확인
농촌진흥청에서 개발한 콩나물용 콩 품종 중에서 배축색과 꽃색이 자색인 품종 다채, 명주나물콩, 소백나물콩, 소원콩, 소진나물콩, 신화, 안평, 원황, 은하콩, 조남, 팔도나물콩 및 풍산나물콩을 2010년에 수원에서 생산하여 실험재료로 사용하였다(Lee et al., 2015a). 각 나물콩 250 g을 2~3회 물에 세척 후 3시간 물에 불린 다음 콩나물재배기(신창INC, 모델명 SC-9000)에 15분간 살수와 45분간 비살수 조건(24회/일)으로 재배하였다. 재배기간 중 재배사 온도 및 상대습도는 각각 17℃와 80%로 유지하였다. 콩나물의 생장상태는 재배 4일차부터 5일차까지 무작위로 20개를 취하여 배축 상단부의 자색의 길이를 측정하였다.
나. 콩나물 재배 시 자색 발현 조건 구명
나물콩은 2011년 제주도에서 생산한 신화 종자를 사용하여 실험을 수행하였다. 재배온도 및 관수온도가 콩나물의 자색발현에 미치는 영향을 알아보기 위하여 콩나물재배기(신창INC, 모델명 SC-9000)를 이용하여 재배온도는 4수준(17, 20, 23, 26℃)으로 하고 관수온도는 각 온도처리별로 2수준(10℃, 재배온도와 동일한 관수온도)으로 하여 재배하였다. 관수온도의 효과에 대한 차이를 유지하기 위하여 매일 2회 물을 교체하여 살수하였다. 살수간격은 15분간 살수와 45분간 비살수 조건(24회/일)으로 하였고, 상대습도 80%를 유지하여 실험하였다. 콩나물 치상 후 3일차부터 5일차까지 각 재배기에서 무작위로 20개체를 취하여 콩나물의 자색의 길이를 측정하였다.
다. 콩나물 재배환경에 따른 자색발현에 대한 통계분석
콩나물 배축의 자색이 재배환경의 영향을 받는지를 알아보기 위해, 재배온도, 관수온도 및 재배기간에 따른 자색발현 개체 비율을 분석하기 위해 ANOVA (Analysis of Variance) 분석을 수행하였다. 모든 분석결과는 3반복으로 수행되었으며, 각 결과에 대한 통계분석은 SAS 프로그램(SAS Institute Inc., Cary, NC, USA)을 이용하였고, Duncan의 다중검정(DMRT, Duncan’s Multiple Range Test)으로 유의성을 검정하였다.
결과 및 고찰
가. 콩나물 품종별 자색발현에 대한 유전적 영향
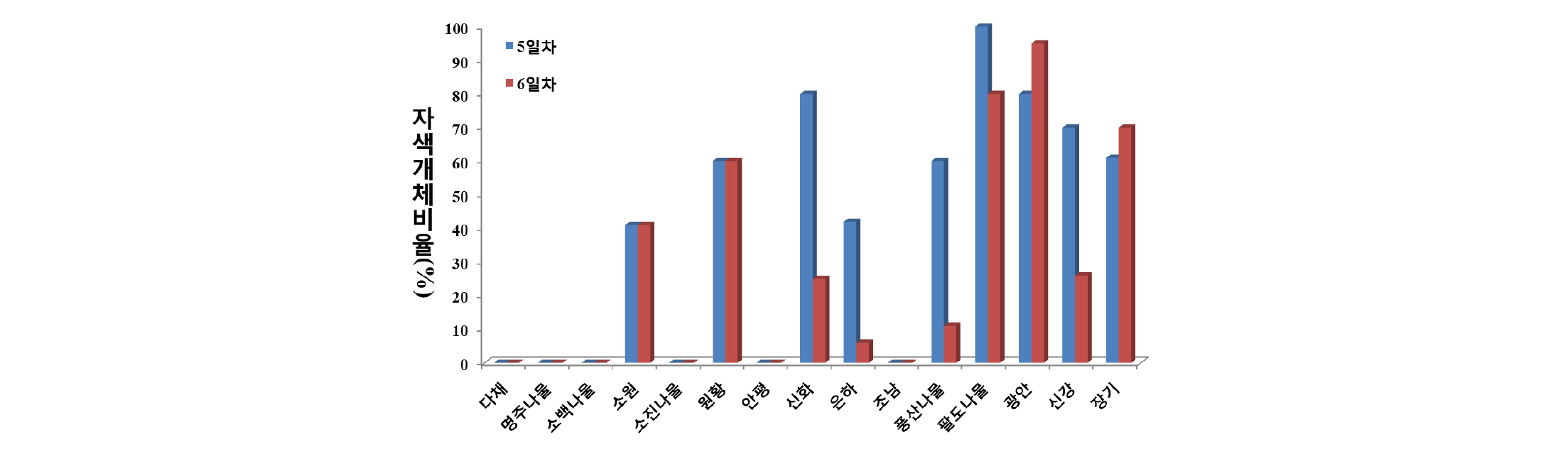
콩나물의 물리화학적 특성과 관능적 특성은 재배기간에 따라 변하는데, 재배 5일째 콩나물이 다른 재배일수의 콩나물보다 선호도가 높다고 하였다(Song et al., 2000). 따라서 본 시험에서도 콩나물을 5일차까지 재배하면서 특성을 조사하였다. 배축색과 꽃색이 모두 자색인 콩나물 콩 15품종을 콩나물재배기에서 재배하면서 콩나물 배축의 자색발현 정도를 조사하였다(Fig. 1). 그 결과, 다채, 명주나물콩, 소백나물콩, 소진나물콩, 안평 및 조남 등 6품종은 배축에서 자색이 발현되지 않았다. 그러나 소원, 원황, 신화, 은하콩, 풍산나물콩, 팔도나물콩, 광안, 신강 및 장기 등 9품종은 배축에 자색이 발현되었다. 이러한 결과들은 배축에서 자색의 발현은 유전적 영향 보다는 환경적 영향에 의해 배축에서 자색 발현을 한다는 것을 의미하는 것이다. 이전의 연구결과에서, T와 W1 유전자에 의해 배축색과 안토시아닌 함량을 결정하지만, 환경적 요인에 의해 배축색도 영향 할 것임을 제시하였다(Murai et al., 2016). 자색이 발현되는 품종 중에서 신화, 은하콩, 풍산나물콩, 팔도나물콩 및 신강 등 5품종은 5일차에 비해 6일차에 자색발현 정도가 감소한 반면, 광안과 장기는 증가하는 양상을 나타났다. 재배 6일차에 자색발현 정도를 살펴보면, 은하콩과 풍산나물콩은 자색발현개체 비율이 10% 미만인 반면에 팔도나물콩, 광안 및 장기는 자색발현개체 비율이 70% 이상으로서 자색발현이 매우 잘 되는 품종으로 나타났다. 자색이 발현된 배축의 품종별 자색길이를 살펴보면 광안 0.55 cm, 팔도나물콩 0.28 cm 및 장기가 0.21 cm로 가장 길었고, 나머지 품종은 배축의 0.1 cm미만을 나타내었다(Fig. 2).
Lee et al. (2015b)은 안토시아닌 고함유 검정콩 유전자원 선발을 위해 1,032점의 유전자원의 총 안토시아닌 함량을 분석한 결과 유전자원에 따라 콩 종실 1 g 당 0.54~23.45 mg의 다양한 범위를 나타낸다고 보고하였다. 또한, Hwang et al. (2014)도 품종에 따라 검정콩 종실의 안토시아닌 함량이 영향을 받는다고 보고하였다. 콩 종실의 안토시아닌 연구결과가 다수 발표되었으나, 콩나물의 안토시아닌에 대한 국내의 연구결과는 발표된 바가 없다. 하지만 본 시험결과에 따르면 콩나물 배축의 자색발현 시기, 발현양상 및 발현량이 콩 품종에 따라 다양하게 나타났다. 이 결과는 콩나물의 안토시아닌 함량은 종실과 마찬가지로 콩나물의 배축에서 자색발현은 유전자형뿐만 아니라 환경적 요인에 영향을 받을 것으로 사료된다.
나. 콩나물 재배환경에 따른 자색발현에 대한 ANOVA 분석
콩 종실의 안토시아닌 함량은 품종 뿐만 아니라, 재배환경의 영향을 받는 것으로 알려져 있다. Hwang et al. (2014)은 검정콩의 안토시아닌 함량은 재배지역, 품종 및 파종기 모두에 영향을 받는다고 하였다. 또한 Hong et al. (2010)은 petunidin-3- glucoside를 제외한 안토시아닌 함량은 위도에 따른 재배지역과 품종 및 계통 간 상호작용이 있어 품종 및 계통에 따라 위도별 재배환경이 영향을 미치는 것으로 판단한다고 하였다. 이에 콩나물 배축의 자색이 재배환경의 영향을 받는지를 알아보기 위해, 재배온도, 관수온도 및 재배기간에 따른 자색발현 개체 비율에 대한 ANOVA 분석을 하였다. 그 결과, Table 1에 나타난 바와 같이 재배온도, 재배기간, 관수온도가 자색발현에 고도로 유의한 요인으로 작용하였으며, 이들 간의 상호작용 효과도 통계적으로 고도로 유의한 것으로 나타났다. 결과적으로 콩나물 배축의 자색발현은 콩 종실의 안토시아닌 함량과 마찬가지로 콩나물 재배환경에 영향을 받는 것으로 나타났다.
Table 1. Analysis of variance for percentage of soybean sprouts with purple hypocotyls under different cultivation conditions. |
|
다. 콩나물 재배환경에 따른 자색발현 정도
재배온도에 따른 자색발현 개체비율은, 재배온도 17℃, 20℃, 23℃에서 32.4~34.2%의 비율을 보였다. 이에 반면, 26℃에서는 17.2%만이 자색으로 나타내어, 재배온도가 제일 높은 시험구에서 자색발현이 가장 낮게 나타났다(Fig. 3A). 또한, 재배기간에 따른 자색발현 정도는 재배 3일째에는 자색발현이 전혀 없었으나, 4일째에 가장 높은 발현비율(52.0%)을 보였다. 그리고 5일째에는 감소하여 36%의 개체가 자색배축을 나타내었다(Fig. 3B). 콩나물의 적정 재배기간이 5~6일 임을 감안할 때 재배 5일째의 자색발현 개체비율이 36%을 나타내고 있어서 콩나물 외관품질에 영향을 줄 것으로 생각되었다. 한편, 관수온도가 제일 낮은 10℃에서 36.%로 가장 많은 개체비율을 보였고 관수온도가 높아질수록 자색발현 개체비율이 점차 감소하여 가장 높은 온도인 26℃에서 가장 낮은 개체비율(7.3%)을 나타내었다(Fig. 3C). 이러한 결과는 검정콩의 안토시아닌 함량은 등숙기간 중 평균기온이 낮고 일교차가 큰 지역에서 증대되고(Hwang et al., 2014), 컬러감자의 안토시아닌 함량도 파종 후 80~100일 사이의 평균온도 및 최저온도가 낮은 지역에서 증대된다(Jeong et al., 2015)는 보고와 유사한 결과라고 볼 수 있었다. 즉 본 시험에서도 온도가 낮을수록 콩나물의 자색발현 개체는 증가하고 온도가 높을수록 자색발현 개체는 감소하는 것으로 나타났다.
라. 콩나물 재배환경 상호관계에 따른 자색발현 정도
재배온도와 재배기간에 따른 자색개체 발현비율은 재배온도에 관계없이 재배 3일차에는 자색발현 개체가 전혀 없었으나 재배 4일차와 5일차에는 재배온도별로 각기 다른 양상을 나타내었다(Fig. 4A). 재배온도 17℃ 에서는 재배 5일차에 가장 많은 자색개체가 발현되었다. 그러나 재배온도 20℃, 23℃, 26℃ 에서는 재배 4일차에 가장 많은 자색개체 비율을 보였고 5일차에는 감소하였다. 특히 26℃ 에서는 재배 5일차에 자색발현 개체가 없는 것으로 나타났다. 각 재배온도별 관수온도에 따른 배축 발현정도를 알아보기 위해, 각 재배온도에서 관수온도를 10℃와 재배온도와 동일한 관수온도를 처리하였다. 그 결과, 17℃를 제외하고 재배온도와 같은 관수온도에 비해 10℃ 물로 관수한 시험구에서 자색발현 개체 비율이 높게 나타났다(Fig. 4B). 재배온도 17℃와 20℃ 시험구에서는 관수온도에 따른 자색발현 개체 비율의 차이가 통계적으로 유의성이 인정되지 않았다. 하지만, 재배온도 23℃와 26℃ 시험구에서는 관수온도가 낮을수록 자색발현 개체비율이 높게 나타났다. 특히 재배온도 23℃, 관수온도 10℃ 시험구에서 자색발현 개체비율이 46%로 모든 시험구 중 가장 높은 자색발현 정도를 보였고, 재배온도와 관수온도를 모두 26℃로 처리한 시험구에서 7%로 자색발현 개체비율이 가장 낮았다. 또한, 관수온도별 재배일수에 따른 자색발현 정도를 조사한 결과, 관수온도에 관계없이 재배 3일차에는 자색을 나타내는 콩나물 개체가 없었으나, 재배 4일차와 재배5일차에서는 관수온도에 따라 자색발현 양상이 다르게 나타났다(Fig. 4C). 관수온도 17℃ 에서는 재배일수가 지날수록 자색발현이 증가하여 재배 5일차에 가장 높은 자색발현을 나타낸 반면, 나머지 관수온도 처리구(10℃, 20℃, 23℃, 26℃)에서는 재배 4일차에 발현이 가장 높게 나타났다가 5일차에는 감소하는 것으로 나타났다. 콩나물 배축의 자색발현은 콩나물의 외관품질에 영향을 미치는 요인으로서, Table 1과 Fig. 4에서 보는 바와 같이 재배환경(재배온도, 재배일수, 관수온도)에 따라 자색발현 양상은 특정한 경향을 나타내지 않았다. 따라서, 우수한 외관품질의 콩나물을 생산하기 위해서는 품종에 따른 재배환경별로 최적의 재배조건을 탐색해야 할 것으로 보인다. 콩나물 재배 시 배축의 자색발현에 대한 재배온도, 관수온도 및 재배기간의 영향을 구체적으로 살펴보면, 재배온도 17℃ 시험구에서는 관수온도에 관계없이 재배기간이 5일차까지 자색발현 개체 비율이 계속 증가하였다. 그리고 재배온도 20℃, 23℃, 26℃에서 관수온도는 10℃, 재배기간은 4일차에서 자색발현 개체가 높았다(Fig. 5). 반면 재배온도 26℃에서는 관수온도에 관계없이 5일차에는 자색발현 개체가 없었으며, 재배온도와 관수온도를 모두 23℃로 한 시험구에서도 재배 5일차에 자색발현 개체가 없는 것으로 나타났다.
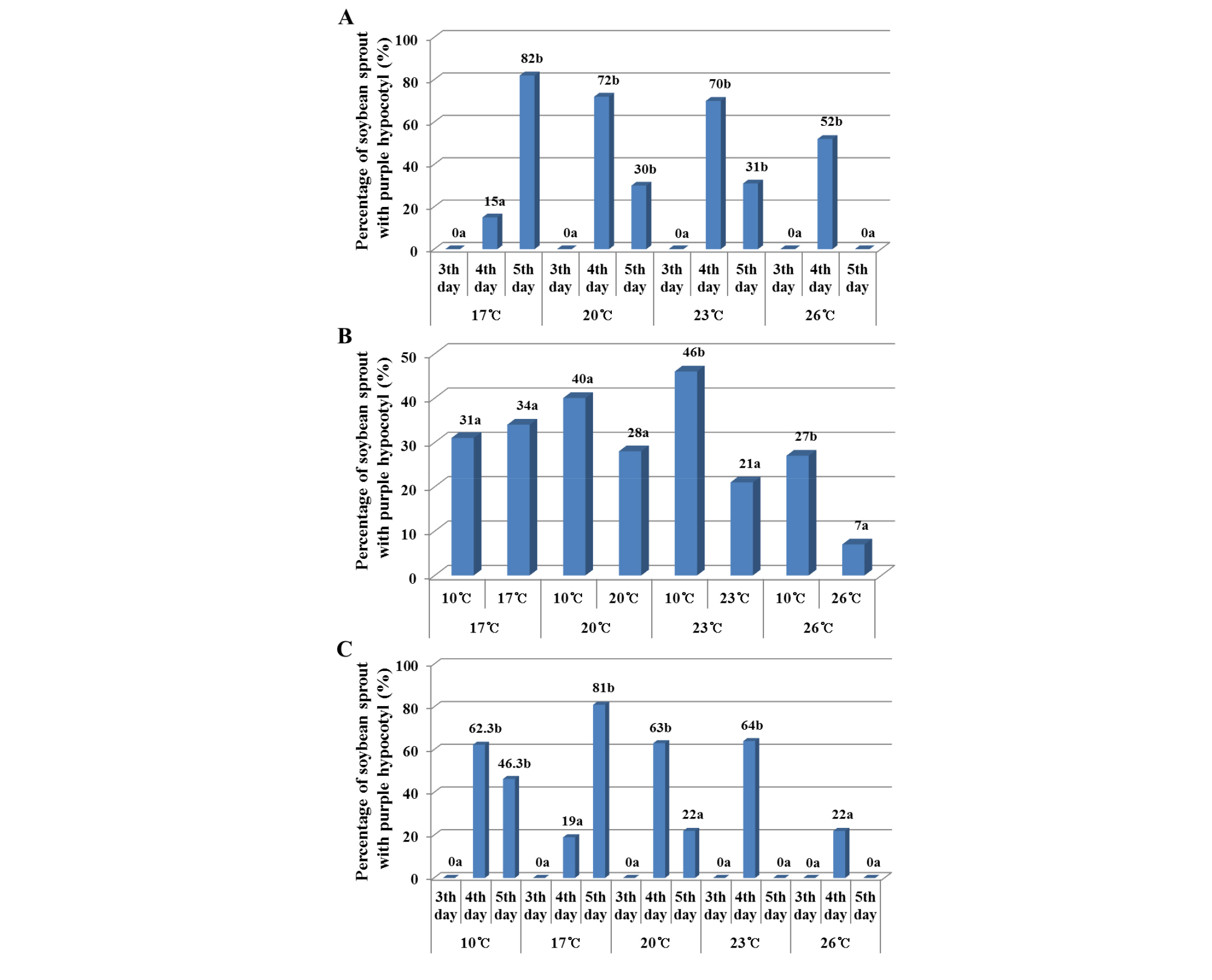
Fig. 4.
Effect of interaction between cultivation conditions on purple color expression in soybean sprout hypocotyls: (A) growth temperature (below) and cultivation period (upper); (B) growth temperature (below) and spray water temperature (upper); (C) spray water temperature (below) and cultivation period (upper). Means followed by the same letter were not significantly different at p < 0.05.
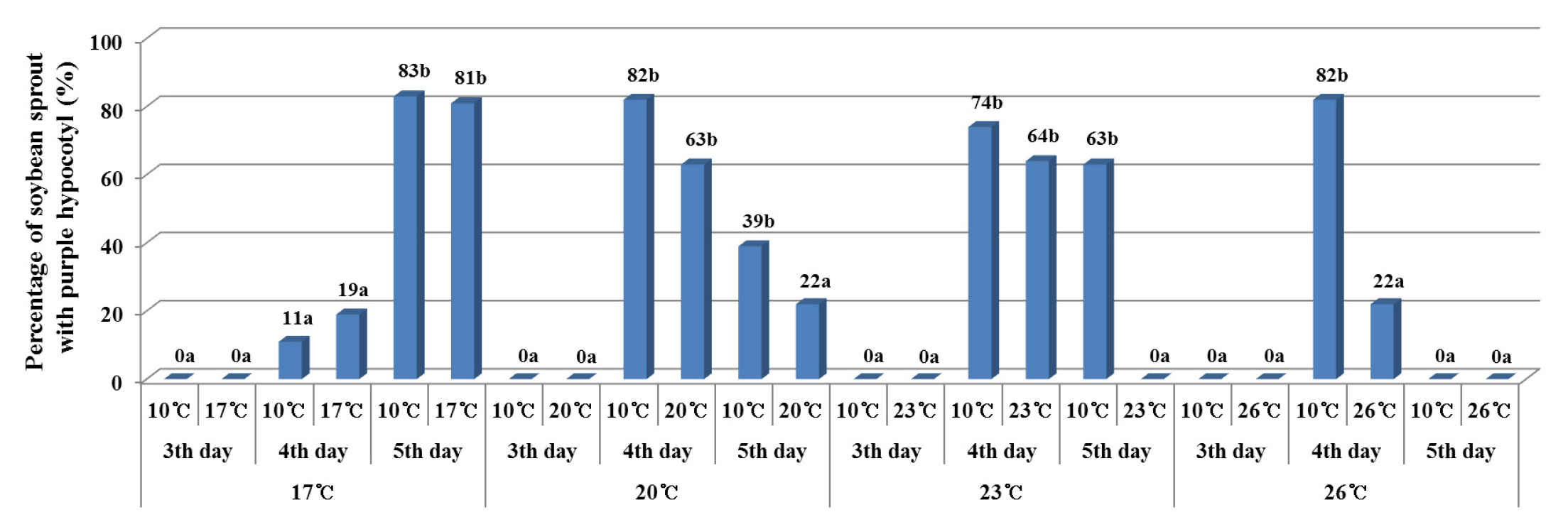
Fig. 5.
Effect of interaction between growth temperature (17 ℃, 20℃, 23℃, and 26℃), cultivation period (3rd day, 4th day, and 5th day), and spray water temperature (10℃, 17℃, 20℃, 23℃, and 26℃) on purple color expression in soybean sprout hypocotyls. Means followed by the same letter were not significantly different at p < 0.05.
콩나물의 생육과 품질은 종자의 품질, 재배온도, 관수시간 및 관수방법 뿐만 아니라 재배일수 등의 요인에 의하여 영향을 받는다. 이 중에서 콩나물의 재배온도와 관수수온은 콩나물의 재배환경에서 가장 중요한 요인이다(Kang & Kim, 1997; Korean Bean Sprouts Association, 1997; Park et al., 1997; Park & Kim, 1998; Bae et al., 1999; Kim et al., 2000). 또한 Bae et al.(2002)은 재배일차별 수온을 다르게 하는 3-stage 방법으로 콩나물을 재배하여 좋은 색택의 규격품의 콩나물 수율을 증가시킬 수 있다고 보고하였다. 본 시험에서도 재배온도, 관수온도 및 재배기간에 따라 콩나물 배축의 자색발현이 다양하게 나타났다. 이러한 환경적인 요인들 중 재배기간이 배축에서의 자색발현이 가장 중요한 요인임을 알 수 있다. 이와 같은 결과를 통해 콩나물 재배 시 재배환경을 조절하면 배축색이 자색인 콩나물 품종을 원료콩으로 사용하더라도 소비자의 기호도가 높은 유백색의 배축을 나타내는 콩나물을 생산할 수 있을 것이다. 그러기 위해서는 품종별, 자색발현과 재배환경과의 보다 정밀한 관계를 구명하기 위해 추후 면밀한 검토가 필요할 것으로 생각된다.
적요
국내에서 육성된 자색배축을 나타내는 품종들의 콩나물 재배시 자색 발현을 조사하고 자색의 배축발현에 관련된 재배요인을 구명하여 자색배축 콩나물 품종을 콩나물 원료콩으로 확대하는데 필요한 기초자료를 제공하고자 시험을 실시하였다. 이에 배축색과 꽃색이 모두 자색인 콩나물 콩 15품종을 콩나물 재배기에서 재배하면서 콩나물 배축의 자색발현 정도를 조사하였다. 그 결과, 다채, 명주나물콩, 소백나물콩, 소진나물콩, 안평 및 조남 등 6품종은 자색이 발현이 되지 않았으나, 소원콩, 원황, 신화, 은하콩, 풍산나물콩, 팔도나물콩, 광안, 신강 및 장기 등 9품종은 자색이 발현되었다. 재배온도, 재배기간, 관수온도가 자색발현에 고도로 유의한 요인으로 작용하였고, 이들 간의 상호작용 효과도 통계적으로 고도로 유의한 것으로 나타났다. 또한, 콩나물 배축의 자색발현은 콩나물 재배환경에 영향을 받는 것으로 조사되었다. 재배온도에 따른 자색발현 개체비율은 재배온도 17℃, 20℃, 23℃에서 32.4~34.2%의 비율을 보인 반면 26℃에서는 17.2% 만이 자색을 나타내어, 재배온도가 제일 높은 시험구에서 자색발현이 가장 낮게 나타났다. 관수온도에 따른 자색발현 개체비율은 관수온도가 제일 낮은 10℃에서 36%로 가장 많은 개체비율을 보였다. 그리고 관수온도가 높아질수록 자색발현 개체비율이 점차 감소하여 가장 높은 온도인 26℃에서 가장 낮은 개체비율을 나타내었다. 재배기간에 따른 자색발현 정도는 재배 3일째에는 자색발현이 전혀 없었으나 4일째에 52%로 가장 높은 발현비율을 보였고 5일째에는 감소하여 36%의 개체가 자색배축을 나타내었다.