서 론
재료 및 방법
시험재료
고구마 전분의 분리 및 함량
고구마 전분의 호화 특성
총 폴리페놀 함량 분석
DPPH 자유라디칼에 대한 전자 공여능 측정
당도 분석 및 수분함량 측정
통계분석
결과 및 고찰
고구마 유전자원 지상부 및 지하부 생육 형질
고구마 유전자원별 전분의 호화 특성
총 폴리페놀 함량 및 전자공여능 측정
당도, 전분 및 수분 함량 분석
적 요
서 론
고구마(Ipomoea batatas L.)는 1965년에서 2014년 사이에 1억톤 이상의 지속적인 세계 생산량을 기록한(FAO) 이질육배체(2n = 6x = 90) 식물로서, 인류를 위한 칼로리, 단백질, 비타민, 미네랄의 중요한 공급원이다(Bovell-Benjamin, 2007). 과거에는 대부분 주식용으로 재배 되었으나, 최근에는 간식으로 주로 이용되며 가공식품에도 이용된다(Lee et al., 2013). 녹말용으로 30% 정도 사용되고 엿‧포도당‧과자류‧식용가공품‧의약품‧화장품 등 다방면으로 이용되고 있다. 또한 알코올‧위스키‧소주 등의 원료로도 사용되고 있다. 감자와 비슷한 용도로 쓰이지만 감자와는 달리 고구마는 순이나 줄기로 김치를 담그거나 반찬으로 먹기도 하며 요리의 딥핑소스로도 이용되고 있다. 이렇게 고구마의 다양한 용도와 웰빙식품으로서 각광을 받고 있어서 앞으로 수요가 점전 더 늘어날 것으로 기대되고 있다. 고구마의 품질은 주요성분인 전분 특성에 따라 큰 영향을 받으며, 품종 및 토양뿐만 아니라 재배조건에 따라 큰 차이를 보인다고 하였고(Collins & Walter., 1986; Han et al., 2014), 고구마의 품질 및 이용성 관련 연구는(Choi et al., 2000; Choi et al., 2011; Han et al., 2012; Lee et al., 2011; Shin et al., 1987; Yukihiroet al., 1997) 다수 보고되어 있으나, 고구마 유전자원 탐색 및 육종에 관련된 연구가 국외에 비하여 매우 부족한 실정으로 다양한 품종 육종 개발에 필요한 유전자원 수집 및 품질특성 조사 연구의 필요성이 대두되고 있다.
따라서 본 연구는 국내외에서 수집된 고구마 유전자원에 대한 작물학적 특성 및 품질특성을 구명하여 유전자원의 다양한 소재로서 유용자원의 선발, 신품종개발 및 재배생산의 기초자료로 활용코자 수행하였다.
재료 및 방법
시험재료
농촌진흥청 국립식량과학원 바이오에너지작물연구소에서 보유중인 고구마 유전자원 181점을 2018년 6월에 삽식을 위해, 시비량은 고구마 표준시비법(RDA, 2002)에 준하여 퇴비 1,000 kg/10a, N-P2O5-K2O = 5.5-6.3-15.6 kg/10a을 전량 기 비로 시용한 후, 로터리 경운을 실시하였다. 비닐은 배색필름 으로 피복하였으며 재식밀도는 휴간거리를 70 cm, 주간거리는 20 cm로 하여 시험구당 40주씩 삽식하였고, 시험구 배치는 분 할구집구배치법 3반복으로 하였다. 재배관리는 농촌진흥청 표준재배법(RDA, 2009)에 준하여 관행재배기간인 120일을 재배하고 수확한 후 지상부와 지하부 특성, 전분, 당도, 수분함량 및 전분 호화특성을 조사하였다. 본 시험에서 공시한 고구마 유전자원 181점은 Table 1과 같다.
Table 1. Sweetpotato germplasms used in this study.
고구마 전분의 분리 및 함량
고구마 전분의 분리 및 함량은 알칼리 침지법으로 분석하였다(Shin&Ahn, 1983). 고구마를 씻어 껍질을 벗기고 자른 후 100 g을 취하여 3배의 0.1% NaOH 용액 300 mL을 가하여 3분간 마쇄하고 100 mesh와 270 mesh에 차례로 통과시켰다. 실온에 정치하여 상층액은 버리고 얻어진 침전물에 0.1% NaOH 용액을 가하는 과정을 4회 반복한 후 증류수로 2회 세척 하였다. 세척된 침전물에 0.1 N HCl을 사용하여 pH 6.5-7로 중 화한 후 40°C에서 20시간 건조시켜 무게를 측정하였다. 고구마 전분 함량은 고구마 생체 100 g당 건조 전분 무게를 측정하여 건물율에 대한 백분율로 나타내었다.
고구마 전분의 호화 특성
전분의 호화 특성은 신속점도측정기(RVA tecmaster, Newportd Scienific, Warriewood, Australia)로 sweetpotato 분석 program을 이용하여 다음과 같이 측정하였다. 즉, 알루미늄 용기에 고구마 전분(14% 수분함량기준) 2.5 g과 증류수 25 mL를 가한 다음 플라스틱 회전축을 이용하여 완전하게 교반시켜 시료액을 제조하였다. 50°C에서 1분간 빠른 속도로 교반한 다음, 분당 7.3°C씩 올리면서 95°C까지 가열하고 이 상태에서 6분간 유지시킨 후, 다시 분당 5°C씩 내리면서 50°C로 냉각시켜 10분간 유지하면서 호화개시온도(pasting temp.), 최고점도(peak viscosity), 최저점도(trough viscosity), 최종점도(final viscosity), 강하점도(breakdown) 및 치반점도(setback)을 구하였다. 모든 결과는 RVA 단위(RVU)로 표시하였다.
총 폴리페놀 함량 분석
총 폴리페놀 함량 분석은 페놀성물질인 phosphomolybdic acid와 반응하면 청남색으로 변화하는 것을 이용한 Folin- Ciocalteu (Dewanto et al., 2002) 방법을 변형하여 수행하였다. 분쇄시료 1 g에 80% methanol 24 ml를 가한 뒤 상온에서 24시간동안 200 rpm으로shaking 한 후 3000 rpm 속도로 10분간 원심분리하여 상등액을 1/10로 희석하여 시료로 사용하였다. 시료 1000 μl에 1N-folin ciocalteu reagent (Sigma Co., USA) 500 μl를 가한 뒤 20% Na2CO3 (Daejung, Korea) 2500 μl를 첨가하고, 3000 rpm으로 10분간 원심분리 후 25°C에서 20분간 반응을 시킨 다음 735 nm에서 흡광도를 측정(Biochrom, Libra S22, England) 하였다. 표준물질은 chlorogenic acid (Sigma Co., USA)를 사용하여 얻은 검량선으로 총 폴리페놀 함량을 계산하였다.
DPPH 자유라디칼에 대한 전자 공여능 측정
전자공여능(EDA; electron donating ability) 측정은 DPPH (1,1-diphenyl-2 -picrylhydrazyl)가 안정된 radical로 보라색을 띄고 있지만 항산화가 활성화 되면 노란색으로 변하는 것을 이용한 방법으로 수행하였다(Blois, 1958; Yoon et al., 2016). 시료 전처리는 총폴리페놀 함량 분석과 동일하게 준비하였다. 시료 1000 μl에 200 μM의 DPPH용액(갈색 플라스크에 99% ethanol에 녹임, Sigma Co., USA) 2.5 ml를 가한 뒤 1분간 반응을 시킨 후 517 nm에서 흡광도를 측정(Biochrom, Libra S22, England)하였다. 표준물질은 L-ascorbic acid (Sigma Co., USA)를 사용하였으며, 전자공여능은 시료와 반응시킨 것과 반응시키지 않은 것의 흡광도 차이를 백분율(%)로 나타내었다.
당도 분석 및 수분함량 측정
당도는 찐고구마 20 g에 80 ml의 물을 넣고 믹서기로 분쇄 후 상온에서 굴절당도계(PR-32α refractometer, ATAGO, Tokyo, Japan)를 이용하여 측정하고 희석배수 5를 곱하였다. 수분함량은 잘게 자른 생고구마 100 g을 80°C에서 예비 건조 한 다음 105°C에서 6시간 열풍 건조 한 후 건물 무게를 측정하여 100 g에서 뺀 값을 %로 나타내었다.
통계분석
모든 실험은 SPSS version 20 software (IBM, Chicago, IL, USA)를 이용하여 p<0.05 수준에서 Duncan의 다중범위 검정으로 시료간의 유의성을 검정하였고 데이터는 3반복의 평균값으로 나타내었다. 상관관계는 로그형 또는 선형 회귀분석을 실시하였다.
결과 및 고찰
고구마 유전자원 지상부 및 지하부 생육 형질
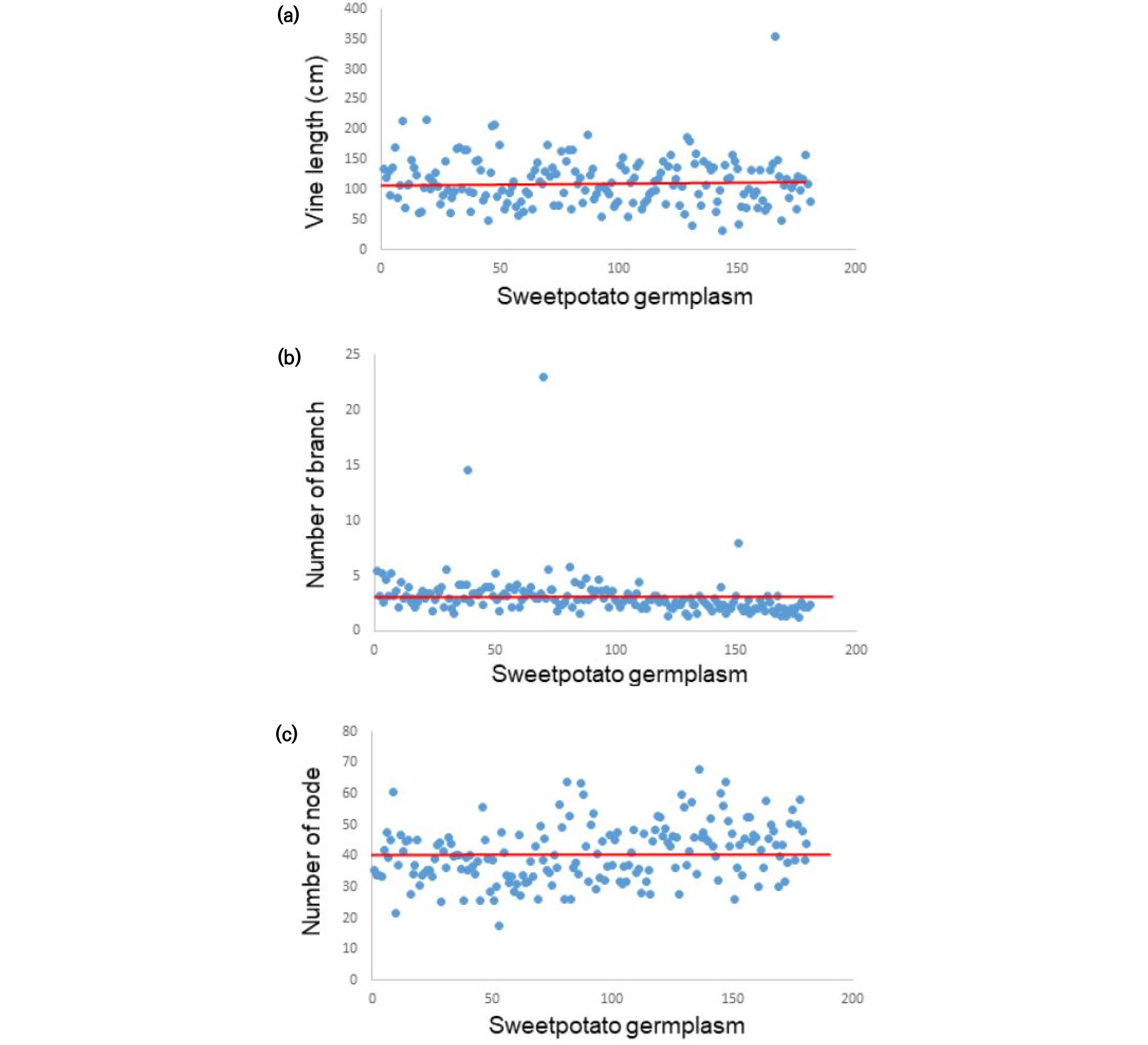
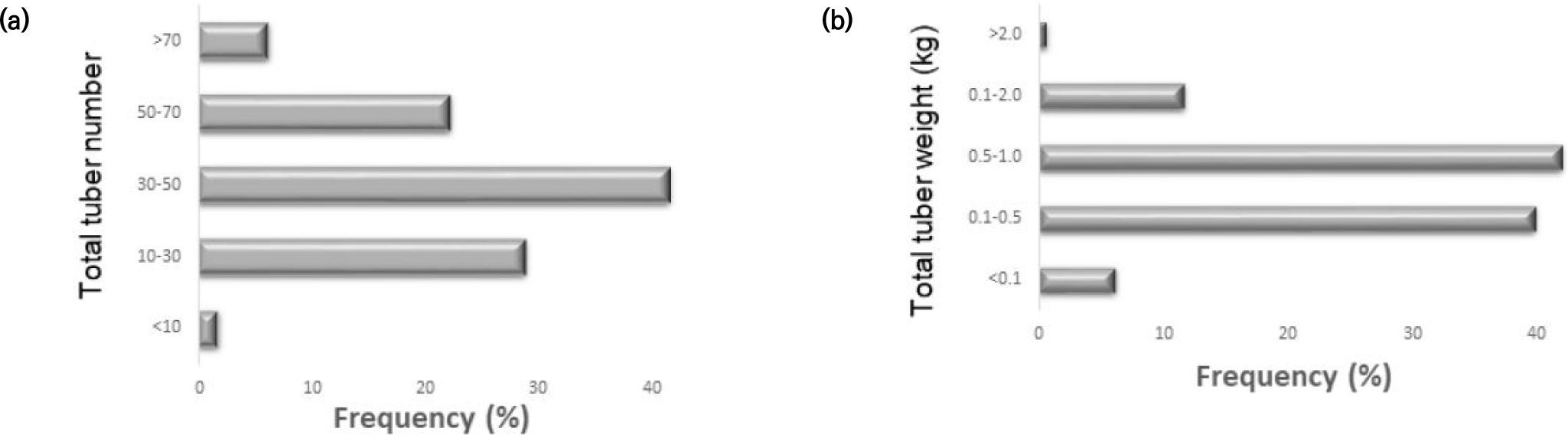
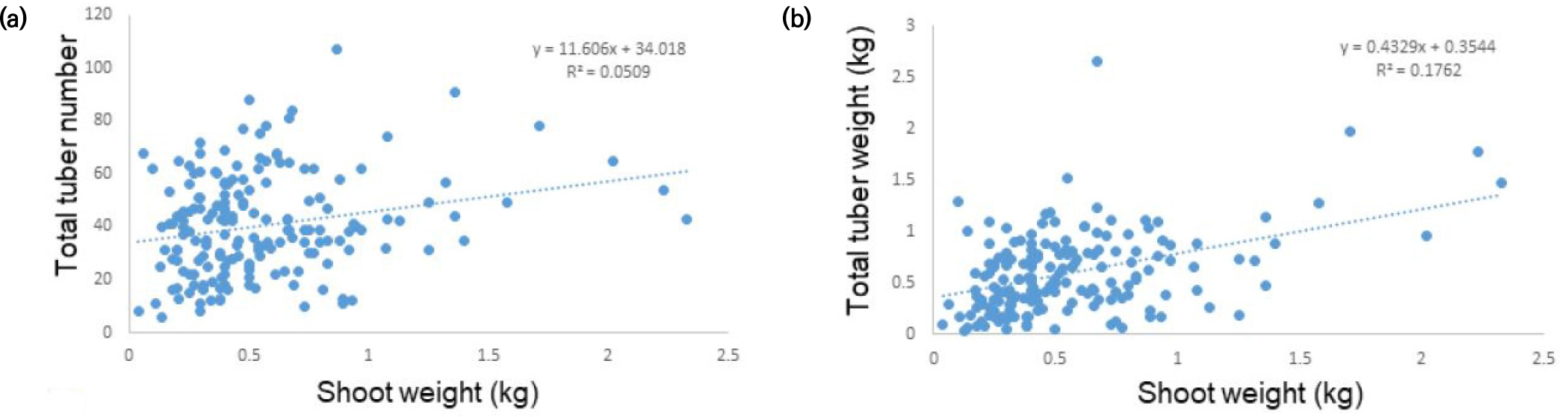
국내외 수집종 181개 고구마 유전자원의 생육조사를 수확기에 실시한 결과 지상부에서 만장은 IT232211가 354.8 cm로 가장 길었고 IT232185가 32 cm로 가장 짧았고 평균길이는 112.3 cm였다(Fig. 1a). 분지수는 평균적으로 3.1개 였으나 IT232091가 특이적으로 23.0개로 가장 많았다(Fig. 1b). 마디수는 17.4개에서부터 67.8개로 다양한 분포를 나타내었으며 평균개수는 40.7개로 나타내었고 IT232174가 67.8개로 가장 많았다(Fig. 1c). 지하부의 괴근수는 주당 30 ~50개 범위가 41.4% (75자원)로 가장 많았으며(Fig. 2a), 괴근 무게는 주당 0.5~1.0 kg 범위가 41.9% (76자원)으로 가장 많았다(Fig. 2b). 이들 자원 중 괴근수 와 괴근 무게가 모두 상위 10%에 해당하는 자원은 총 5자원 IT232029, IT 232062, IT232035, IT232114, IT232131 으로 나타내었다. 한편 고구마 유전자원을 전체적으로 지상부 생체중과 괴근수(Fig. 3a) 및 괴근 무게(Fig. 3b)와 상관관계분석을 실시한 결과 유의성은 인정 되지 않았다. 이는 지상부 무게가 괴근무게 및 괴근수와 높은 양의 상관관계를 보고한 결과와 다르게 나타났다(Lin et al., 2007; Lee et al., 2016). 이러한 차이는 고구마 유전자원 181점이 세계 각 국에서 수집된 것으로서 자원 특성이 서로 다르기 때문인 것으로 사료된다.
고구마 유전자원별 전분의 호화 특성
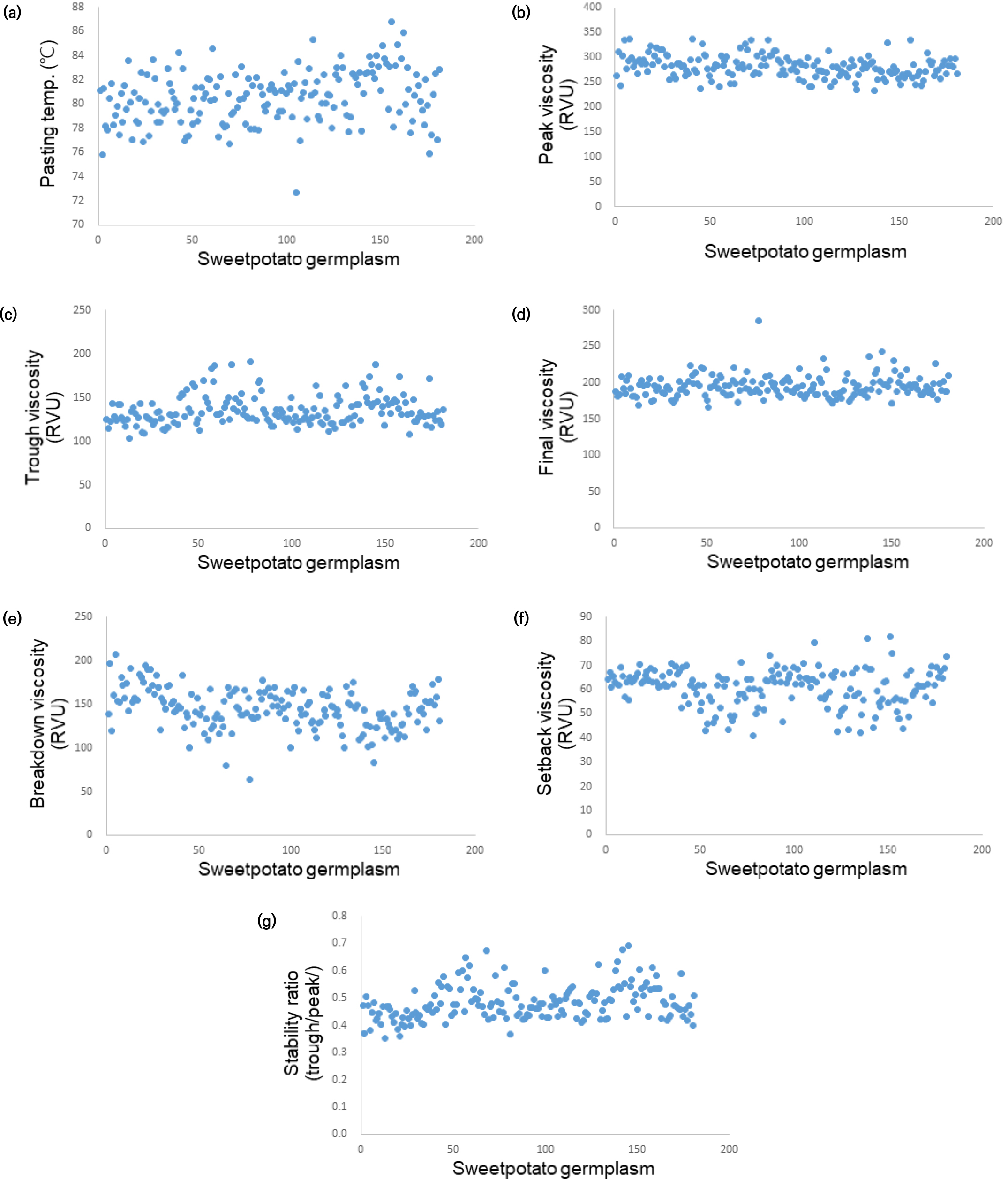
고구마 전분의 호화특성은 Rapid Visco Analyser를 이용하여 분석한 결과, 전분의 호화 개시온도, 최고, 최저, 강하점도 및 최종점도, 치반점도가 유전자원 별로 차이를 보여주었다(Fig. 4). 전분의 호화개시온도(pasting temperature)는 전분입자 구조의 치밀도를 유출할 수 있는 정보 이용되고 있으며 분질고구마 전분이 점질고구마 전분보다 다소 높은 경향을 나타낸다(Oh&Hong, 2008; Han et al., 2013). 본 연구에서 고구마 유전자원 중에 IT232197 86.8°C로 가장 높았으며, IT232134가 72.7°C로 가장 낮았다(Fig. 4a). 최고점도(peak)는 IT232050가 338.3 Rapid Visco Unit (RVU)로 가장 높게 나타났으며, IT232176가 233.3 RVU로 가장 낮았다(Fig. 4b). 최저점도(trough)는 IT232019가 103.8 RVU로 가장 낮게 나타났다(Fig. 4c). IT232101는 가장 높은 최종점도(284.6 RVU)를 나타냈다(Fig. 4d). 강하점도(breakdown)는 IT232010가 207.2 RVU로 가장 높게 나타났으며, IT232101이 63.6 RVU로 가장 낮았다(Fig. 4e). 최종점도가 높고 강하점도가 작은 품종은 열과 전단력(shear force)에 대한 저항성이 커서 점도를 증가시키는 식품 첨가물로 사용이 적합한데(Park et al., 1999), 고구마 유전자원 중에 IT232101이 이러한 조건을 충족하였다. 한편 50°C 냉각점도와 가열시의 점도 차이를 보여주는 치반점도는 노화 정도를 나타낼 수 있다(Baek&Shin, 1995; Choi et al., 2000). 고구마 유전자원의 치반점도는 최대 81.7 RVU (IT232192)에서 최소 40.8 RVU (IT232101)의 범위로 나타났다(Fig. 4f). 전분의 노화 정도는 재배 환경 요인보다는 품종 특성에 더 영향을 받는 경향이 있다(Lee et al., 2016). 전분의 노화 정도의 고저에 따라 적합한 가공식품이 있기 때문에(Katayama et al., 1999), 본 실험에서 얻은 고구마 유전자원 전분의 치반점도 결과는 전분의 노화 경향 정보를 제공해 줌으로서 고구마 전분을 이용한 가공식품별로 적절한 고구마 품종 선택에 도움이 될 것으로 사료 된다. 마지막으로 전분 점도의 안정성(stability ratio)은 최저점도를 최고점도로 나누어 구하였다(Park et al., 1999). 그 결과, 전분의 안정성은 IT232186가 0.69로 가장 높았으며 IT232019가 0.35으로 가장 낮게 나타났으며, 평균 수치는 0.51이었다(Fig. 4g).
전분의 호화특성에 영향을 미치는 주요 인자로는 전분입자의 크기, 아밀로스와 지방 함량 및 아밀로펙틴의 구조 등이 있다(Kim&Ahn, 1992). 이러한 요인들의 차이가 고구마 유전자원별로 다양한 전분의 호화특성을 나타낸 것으로 보인다. 종합적으로 본 고구마 유전자원의 전분 호화 특성 자료는 가공 식품과 산업 소재로의 이용 시 유용한 정보를 제공 할 수 있을 것이다.
총 폴리페놀 함량 및 전자공여능 측정
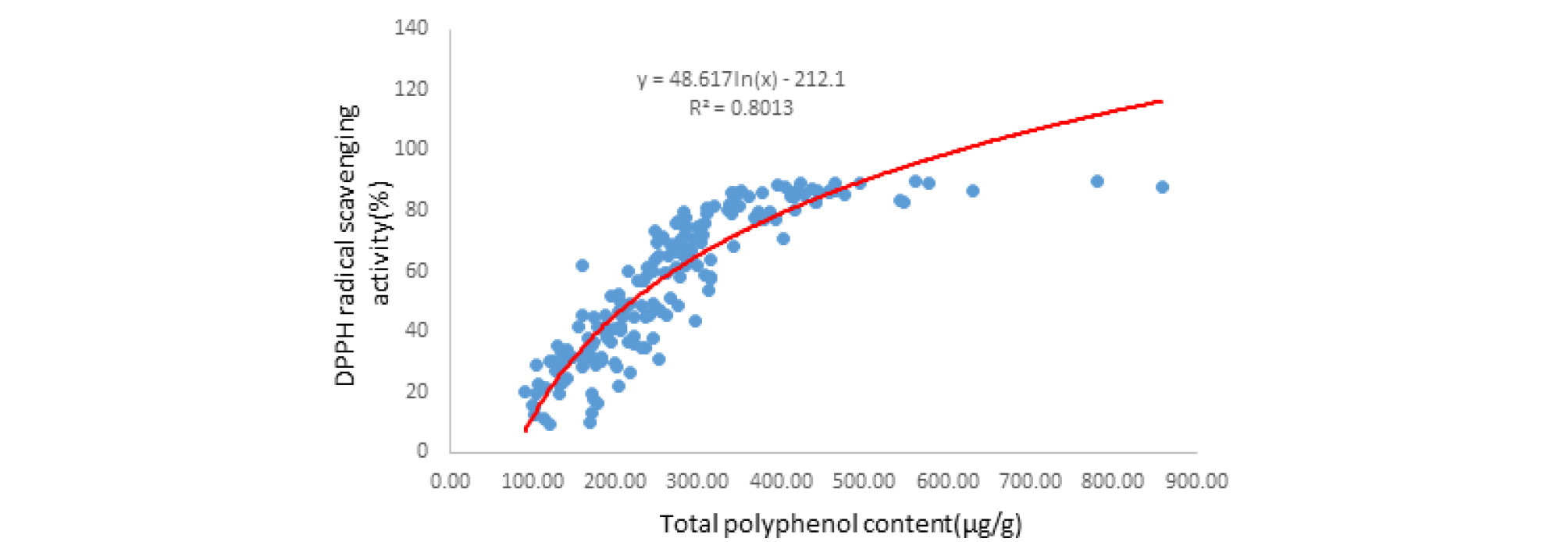
고구마 유전자원별로 기능성물질이면서 항산화 성분으로 알려진 폴리페놀함량 및 항산화능력을 비교하기 위한 DPPH 라디칼 소거능의 차이를 알아보았다(Middleton et al., 1997). 먼저 총 폴리페놀 함량이 가장 높게 나타난 자원 IT232197 (858.3 μg/g)을 포함하여 유전자원들 중 상위 20위 까지 리스트를 Table 2에 보여주었다. DPPH 라디칼 소거능은 또한 IT232177 (89.8%)을 포함하여 상위 20위까지 리스트를 Table 3에 나타내었다. 총 폴리페놀함량과 DPPH 라디칼 소거능의 상관관계 로그회귀분석 한 결과 99.9% 수준으로 R2=0.8013의 높은 상관관계가 나타나 총 폴리페놀함량이 높을수록 DPPH 라디칼 소거능이 증가함을 알 수 있었다(Fig. 5). Tables 2과 3에 표시된 자원들 중 IT232188 등 5자원을 제외하고 총 폴리페놀함량과 DPPH 라디칼 소거능이 모두 상위 20위 안으로 나타났다. 이는 총 폴리페놀 함량과 DPPH 라디칼 소거능이 비례하는 경향을 나타낸 다른 작물의 기존 연구 결과와 유사하였다(Yoon et al., 2016; Lee et al., 2018).
Table 2. Top 20 of 181 sweetpotato germplasms, as ranked by total polyphenol content in tubers.
Table 3. Top 20 of 181 sweetpotato germplasms, as ranked by DPPH radical scavenging activity in tubers.
*Values (Mean ± SD) with different letters in the same column are significantly different (p < 0.05).
당도, 전분 및 수분 함량 분석
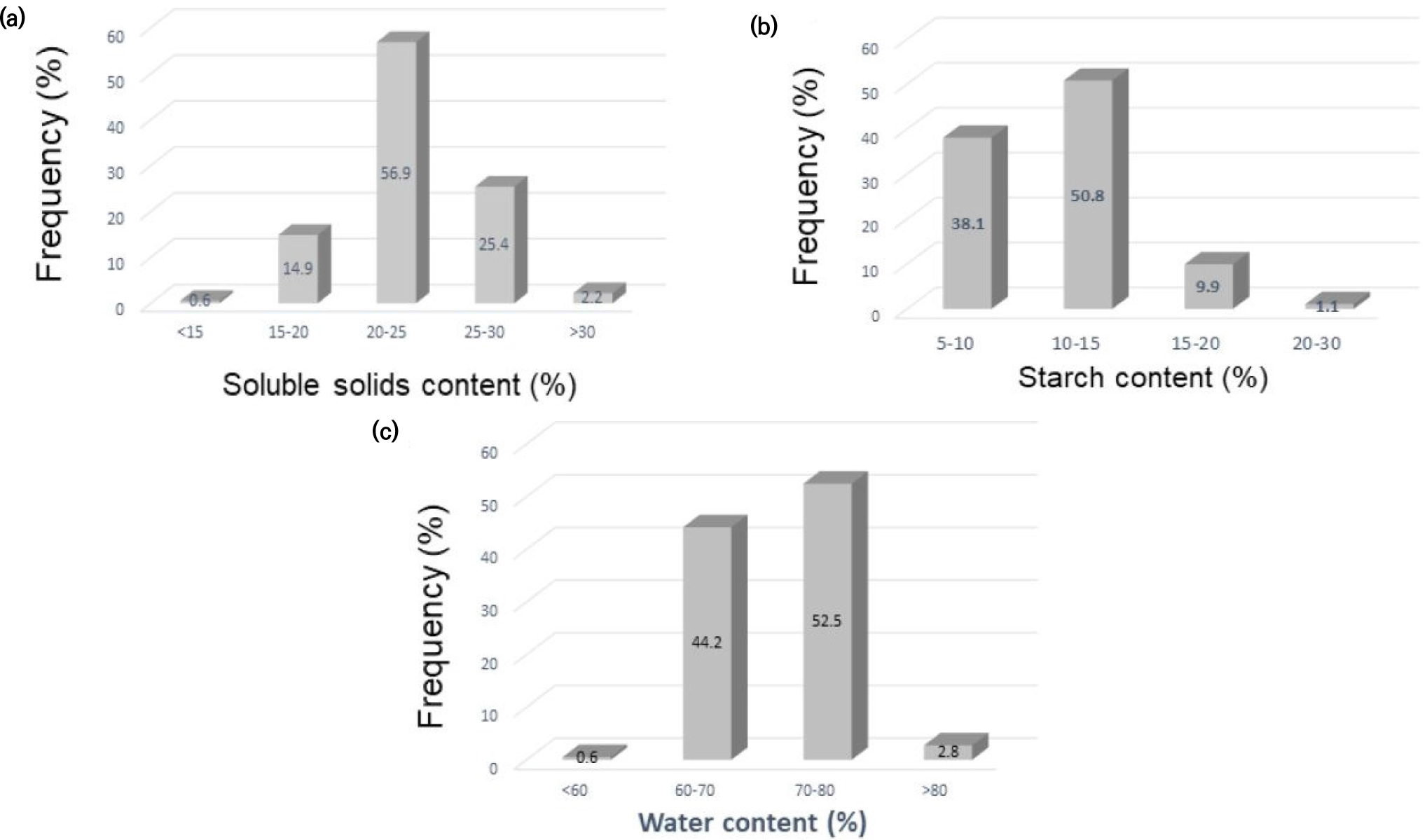
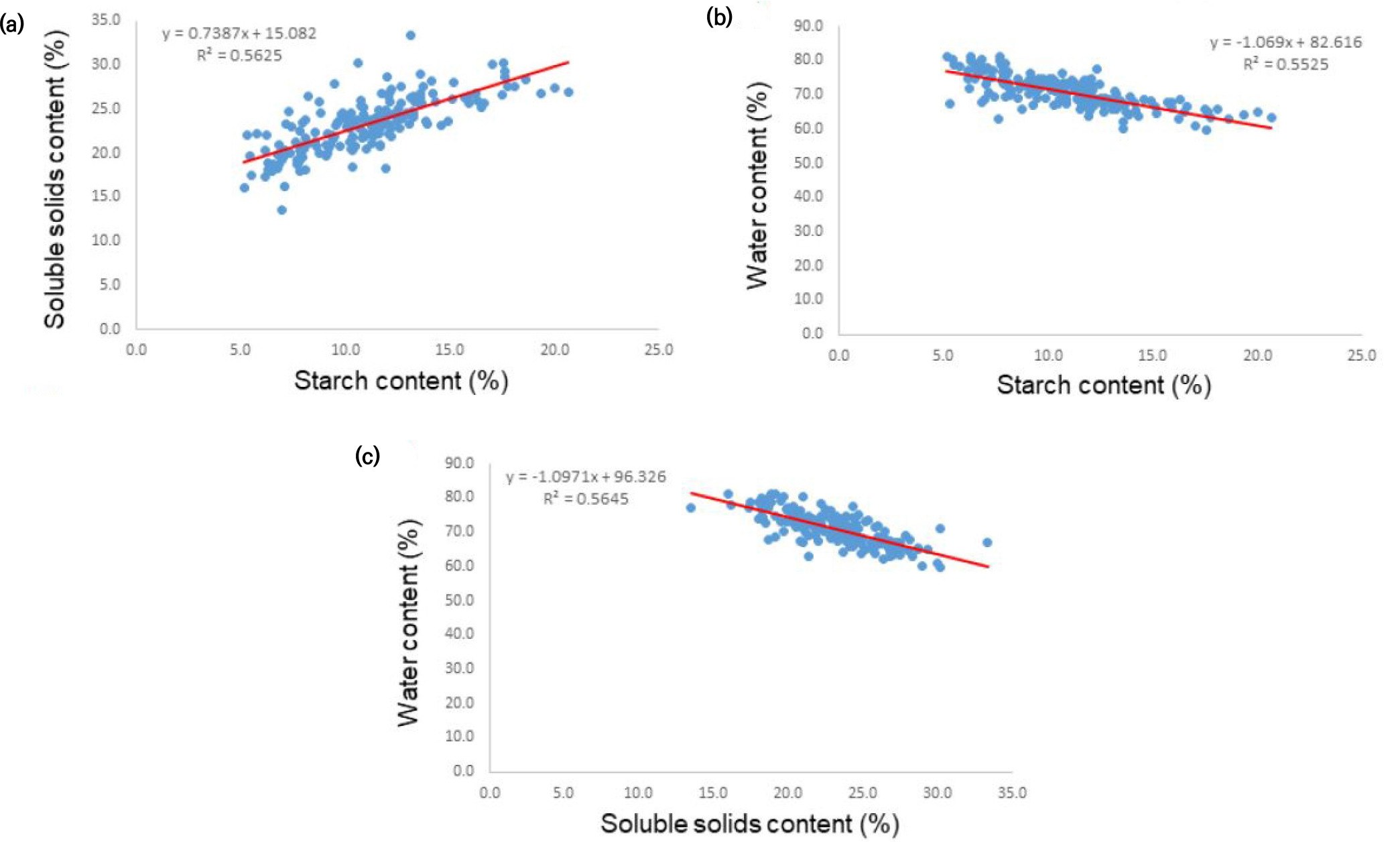
고구마 181유전자원의 당도 범위는 최대 33.3 °Bx에서 최소 13.5°Bx로 나타났으며, 평균 23.2°Bx의 당도를 나타냈다. 20~25°Bx의 당도를 나타내는 고구마 유전자원이 56.9% (103자원)로 가장 많은 빈도를 보여주었으며 다음으로는 25~30°Bx 범위가 25.4%로 총 46자원이 속하였다(Fig. 6a). 당도가 가장 높게 나타난 자원 IT232225을 포함하여 유전자원들 중 상위 20위까지 리스트를 Table 4에 보여주었다. 전분 함량은 최대 20.7%에서 최소 5.2%로 나타났으며, 평균 11%의 전분 함량을 나타냈다. 10~15%의 전분 함량을 나타내는 고구마 유전자원이 50.8% (92자원)로 가장 많은 빈도를 보여주었으며 다음으로는 5~10% 범위가 38.1%로 총 69자원이 속하였다(Fig. 6b). 전분을 가장 많이 함유 하고 있는 자원 IT232006을 포함하여 유전자원들 중 상위 20위까지 리스트를 Table 5에 보여주었다. 수분함량은 70~80% 범위가 52.5%로 가장 높은 빈도수를 보여 주었으며 다음으로 60~70%의 수분함량이 44.2%의 빈도를 나타내었다(Fig. 6c). 고구마 유전자원들의 수분함량은 전분함량 및 당도와 유의한 부의 상관관계를 나타내어 수분함량이 높을수록 전분함량 및 당도가 낮아짐을 알 수 있었다. 한편 전분함량은 당도와 정의 상관관계를 나타내어 당도가 높을수록 전분함량이 높다는 것을 알 수 있었다(Fig. 7).
Table 4. Top 20 of 181 sweetpotato germplasms, as ranked by soluble solids content in tubers.
Table 5. Top 20 of 181 sweetpotato germplasms, as ranked by starch content in tubers.
적 요
최근 식용 위주에서 가공으로 용도가 다양화 되고 있어 괴근 수량 및 기능성 물질 등 괴근 품질 특성차이를 조사하여 용도별 고구마 품종 개발 및 가공 연구 등에 활용할 수 있는 기초자료를 얻고자 국내외에서 수집된 고구마 181유전자원을 공시하여 실험을 실시한 결과는 다음과 같다.
1. 만장은 최대 354.8 cm, 최소 32 cm, 평균길이는 112.3 cm였다. 분지수는 평균 3.1개였으나 IT232091가 특이적으로 23.0개로 가장 많았다. 마디수는 17.4에서 67.8개로 다양한 분포를 나타내었으며 평균 40.7개였다. 괴근수는 주당 30~50개 범위가 75자원로 가장 많았으며, 괴근 무게는 주당 0.5~1.0 kg 범위가 76자원으로 가장 많았다.
2. 전분의 호화개시온도는 IT232197가 가장 높았으며, IT 232134가 가장 낮았다. 최고점도는 IT232050가 가장 높게 나타났으며, IT232176가 가장 낮았다. 강하점도는 IT 232010가 가장 높게 나타났으며, IT232101이 가장 낮았다. 최저점도는 IT232019가 가장 낮게 나타났다. IT232 101는 가장 높은 최종점도(284.6 RVU)를 나타냈다. 치반점도는 최대 81.7 RVU (IT232192)에서 최소 40.8 RVU (IT232101)의 범위로 나타났다. 전분의 안정성은 IT23 2101가 0.65로 가장 높았으며 IT232019가 0.20으로 가장 낮게 나타났다.
3. 총 폴리페놀 함량과 DPPH 라디칼 소거능이 높은 고구마를 각각 20자원씩 선발하였으며 그 중 IT232197을 포함하여 15자원이 중복된 자원임을 알게 되었다. 상관관계 분석 결과 폴리페놀함량이 높을수록 DPPH 라디칼 소거능이 증가함을 알 수 있었다.
4. 당도 범위는 최대 33.3 °Bx에서 최소 13.5°Bx로 나타났으며, 평균 23.2°Bx의 당도를 나타냈다. 전분 함량은 최대 20.7%에서 최소 5.2%로 나타났으며, 평균 11%의 전분 함량을 나타냈다. 수분함량은 70~80%범위가 52.5%, 60~70%의 수분함량이 44.2%의 빈도를 나타내었다.