서 론
재료 및 방법
재배 관리 및 고온 처리
생육 조사
기관별 초분광 특성 분석
통계처리
결과 및 고찰
비가림하우스 온도 환경과 출수기
고온 조건에서 잎의 생리적 변화
고온처리에 의한 종실 등숙 변화 및 수량 조사
초분광 분석을 통한 기관별 식생지수
적 요
서 론
밀은 전 세계적으로 다양한 환경에서 재배되는 온대 작물로서 최적온도 범위는 17~23°C로 알려져 있다(Porter & Gawith, 1999). 이는 우리나라에서 밀 생육기간 동안의 온도보다 높다. 따라서 기후 변화로 인한 낮은 수준의 온도 상승이 밀 재배의 경우에는 긍정적인 효과도 보일 것으로 생각된다. 일반적으로 고온 조건에서는 생육이 저하되나 생육 가능한 최고 온도는 47°C이며 경화된 밀에서는 이보다 높은 온도까지 생장할 수 있다고 한다(Drozdov et al., 1984). 전세계적으로 볼 때 고온 지역으로 밀 재배가 확대되고 있지만, 열대 및 아열대 지역의 고온은 밀 생산의 제한 요인 중 하나이다.
기후변화와 관련하여 IPCC는 1990년부터 2100년까지 지표 온도가 약 1.4~5.8°C 정도 상승할 것이라고 추정하였고(United Nations Environmental Programme, 2006), 또한 지구 온난화는 지속적으로 문제가 될 것이므로 온도 상승에 대한 주요 작물들의 반응을 평가하는 것은 중요하다. 따라서 작물 분야의 연구자들은 지구 온난화와 밀의 등숙 및 수량 간의 관계에 대한 연구들을 진행하고 있다(Ferris et al., 1998; Kaur et al., 2020; Rahman et al., 2009; Shah & Paulsen, 2003; Talukder et al., 2014). Burke (2001)와 O’Mahony & Burke (2000)에 따르면 고온에 노출된 작물들은 고온 한계점에서 다양한 저항 시스템이 작동하여 고온 피해가 일시적으로 감소될 수 있으며, 치명적인 온도에서도 작물이 보호될 수도 있다고 하였다. 그러나 일반적으로 밀은 고온에서 엽록체 구조 및 기능이 떨어지게 되는데, 엽록소 함량 감소로 인한 광합성 저하와 잎의 노화, 종실 등숙기간 감소 등이 발생하고, 특히 영양생장기보다 생식생장기에 고온스트레스로 인한 작물 수량 감소가 더 높다고 한다(Farooq et al., 2011).
작물 생장 단계에서 양분 축적은 최종 수량에 영향을 미치는데, 종실 등숙 단계에 특히 크게 영향을 준다. 즉, 고온은 종실 등숙 단계에서 큰 영향을 끼치는 환경 요인으로써 출수기 전후 고온에 노출시키게 되면, 밀의 수량이 감소하고 등숙률이 낮아지고(Hunt et al., 1991; Sofield et al., 1977; Wardlaw & Moncur, 1995), 등숙기 동안 고온 스트레스로 인한 밀 잎의 생리적 형질과 종실중 감소로 수량 손실이 발생한다고 한다. 또한 고온에서 등숙률이 높아질 수도 있지만, 고온 스트레스에 의한 종실수와 종실중 감소 등의 부정적인 영향은 회복될 수 없다고 한다(Dias & Lidon, 2009; Prasad et al., 2006; Pradhan & Prasad, 2015).
포장에서 진행되는 작물의 생육 평가는 인력과 시간이 많이 요구되는 작업이기 때문에 신속하면서 효율적인 개발이 요구되고 있다. 최근 포장에서 작물 생육 분석에 이용되는 비파괴적 방법으로 초분광 분석법이 각광 받고 있다. 초분광 분석은 식물의 영상 데이터에 기반하여 다양한 생리적 상태와 생장 특성을 빠르게 분석할 수 있어서 농업에서 활용성이 높아지고 있다. 따라서 본 연구는 극단적 고온이 아닌 기후변화 시나리오에서 예상 가능한 수준의 온도 상승이 밀에서 잎의 생리적 변화와 종실의 생장 변화를 확인하고, 출수기 이후 기관별 초분광 영상 데이터에서 추출된 다양한 식생지수 분석을 통해 온도 상승의 영향을 확인하고자 실시하였다.
재료 및 방법
재배 관리 및 고온 처리
본 연구의 포장시험 지역은 경상남도 진주시 가좌동에 위치한 경상대학교 부속농장 전작포장 비가림 시설에서 수행되었다. 공시재료는 국내에서 육성된 경질밀 품종인 조경밀을 이용하였으며, 파종 전 경운 및 기비 처리 후 파종은 2020년 11월 9일에 재식거리 25 cm × 10 cm로 세조파(파종량 14 kg 10a-1)로 실시하였다. 시비량은 10a 당 N-P2O5-K2O 성분량 기준으로 9.1-7.4-3.9 kg으로 인산과 칼륨을 전량 기비 처리하였으며, 질소 추비는 1차와 2차로 나누어 2월 16일과 3월 11일에 각각 2.74 kg 10a-1 시용하였다. 기타 재배 관리는 농촌진흥청 밀 표준재배법에 준하였다(RDA, 2011).
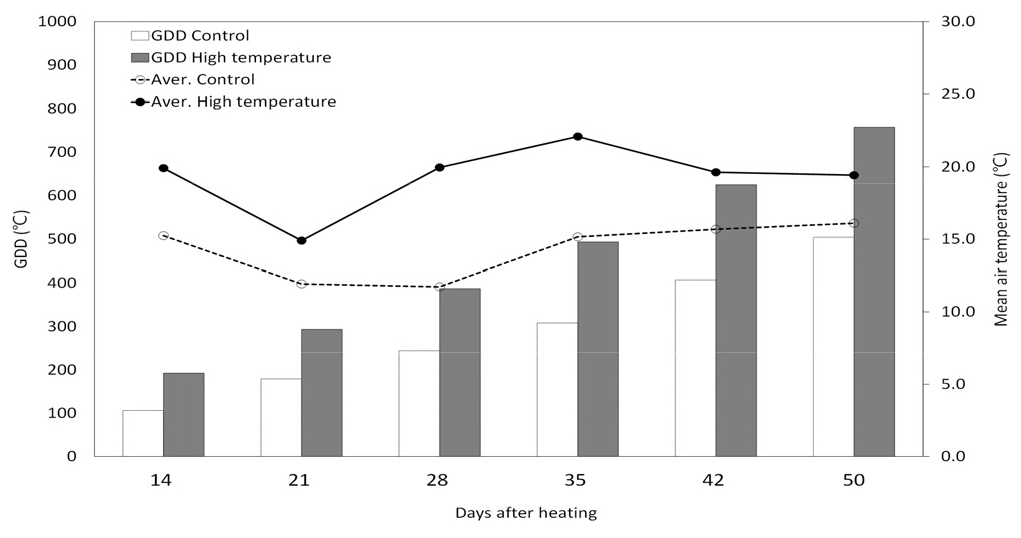
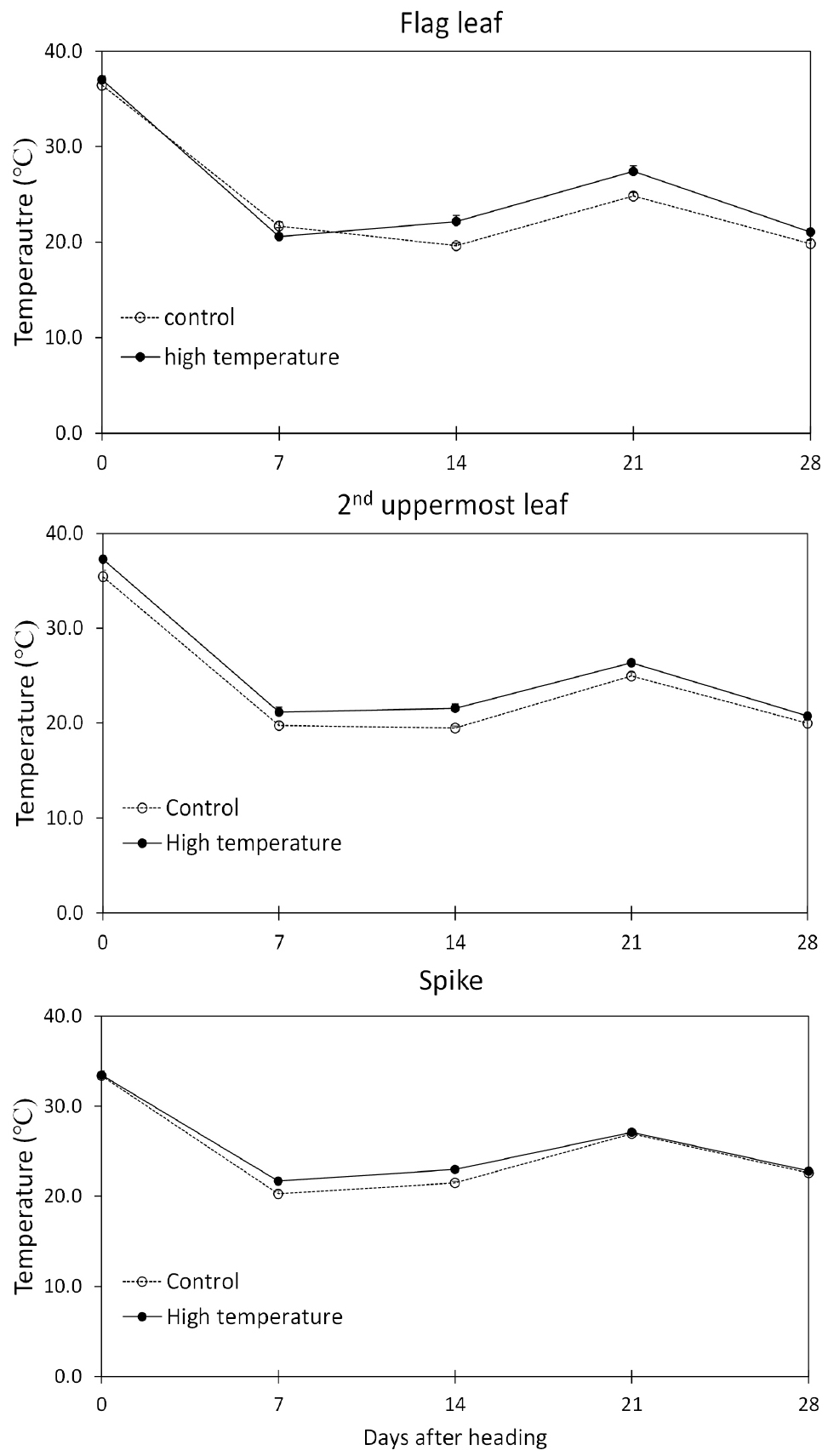
온도 변화는 작물 초관 높이에 온도계를 설치하여 기록하였고, 고온 조건은 비가림 시설내 500w 온풍기 6대를 육각형으로 초관 위 10 cm 높이에 설치 후 15도 하부로 기울여 초관 내로 열이 전달되도록 하였다. 고온 조건은 수잉기부터 수확기까지 유지시켰고, 온도 조건은 IPCC의 기온 상승 예상치와 다른 연구자들이 제시한 생육기간 중 고온처리 수준을 고려하여(Marcos-Barbero et al., 2021; Jurkonienė et al., 2021), 무처리구에 비해 고온 처리구 온도를 일평균기온보다 4°C 높게 설정하였다(Fig. 1).
생육 조사
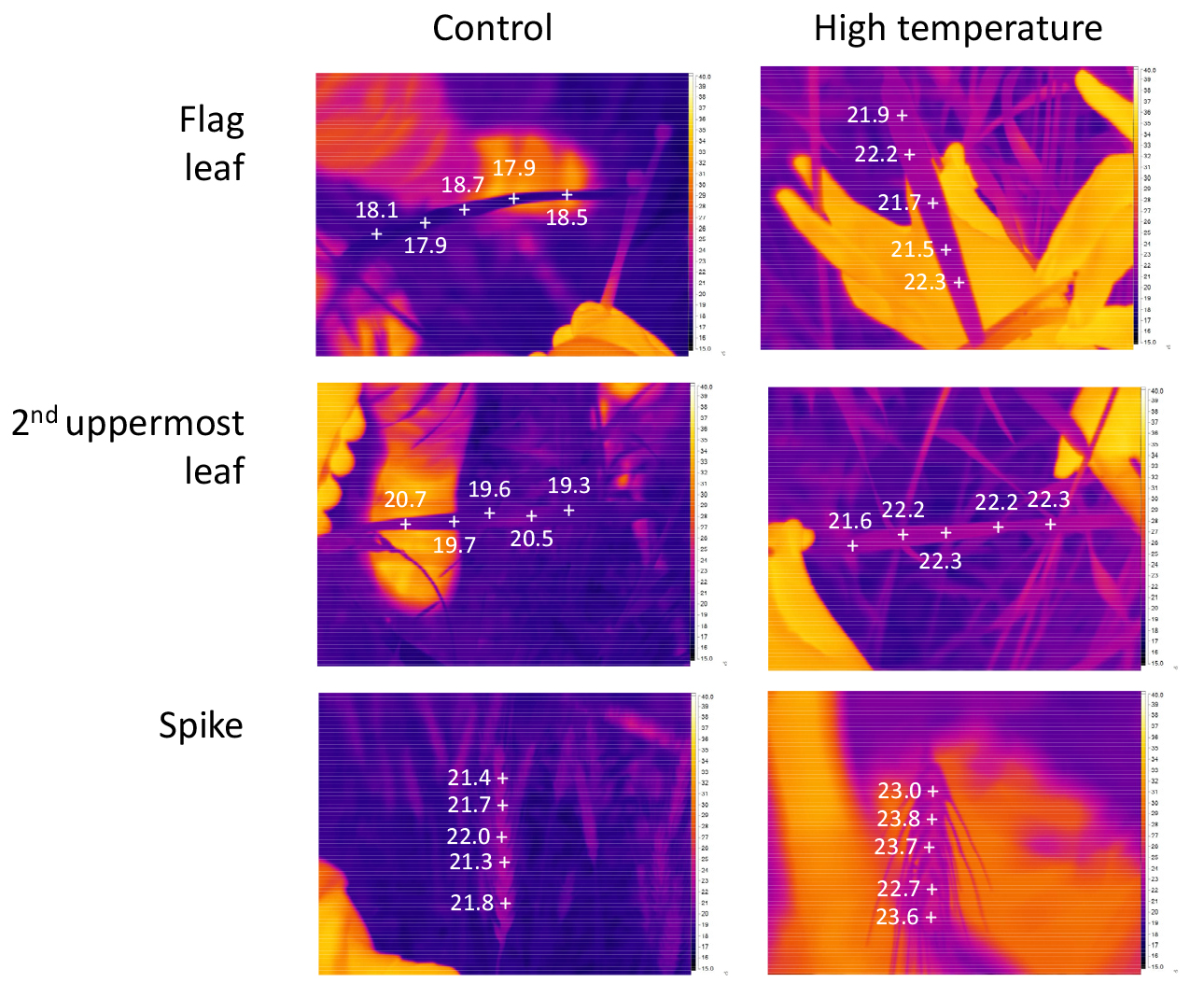
조사 기간은 무처리구의 출수기에 해당하는 2021년 3월 30일부터 성숙기에 해당하는 5월 26일까지 일주일마다 조사하였다. 생리적 특성 조사는 각 처리별 지엽과 최상위제2엽에서 휴대용 엽록소계(SPAD-502, Minolta, Osaka, Japan)를 사용하여 엽녹색도(SPAD value)와 형광측정기(OS-30P, Opti-sciences, Hudson, NH, USA)를 사용하여 OJIP를 측정하였다. 광합성 형질은 휴대용 광합성측정기(CID-340, Bio-Science, USA)를 이용하여 광합성률(Pn)과 증산율(E) 및 기공전도도(C)를 조사하였다. 열화상 분석은 열화상카메라(Ti 400, Fluke. USA)을 사용하여 이삭을 포함한 지엽과 최상위제2엽에 대해 실시하였다. 생육 조사는 각 처리별 줄기 당 건물중과 종실 등숙 형질인 줄기당 이삭중, 종실중 등을 조사하였으며, 등숙이 완료된 후 수량구성요소인 m2당 이삭중과 종실수량 및 1000립중을 조사하였다.
기관별 초분광 특성 분석
고온 처리에 따른 기관별(지엽, 최상위제2엽과 이삭)의 초분광학적 특징을 알아보기 위해서 초분광카메라(Specim IQ, Specim Ltd, Oulu, Finland)를 이용하여 초관 위 20 cm높이에서 촬영하였다. 촬영 시 지상과 평행하게 카메라를 위치하였고, 광은 100w 할로겐등을 초관 위 30 cm 높이에서 조사하였다. 카메라의 광 보정을 위해 reference plate는 파장 범위에 100% 반사율을 지니는 99% barium sulfate를 이용하였다. 촬영한 이미지는 ENVI 5.1 (Exelis Visual Information Solution, Inc, Pearl East Circle Boulder, Co, USA)을 이용하여 가시광선부터 적외선(400~900 nm)까지 파장 반사율을 추출하여 식생지수를 분석하였다.
통계처리
생육 데이터는 SAS 프로그램(ver. 9.4 SAS Inst. North Carolina, US)을 이용하여, 분산분석을 실시하였고, 처리간의 유의성이 있을 경우 5% 유의 수준에서 Tukey test를 통해 비교하였다.
결과 및 고찰
비가림하우스 온도 환경과 출수기
수잉기에 시작된 고온 처리 이후 비가림하우스 내의 일평균기온은 무처리구가 14.2°C, 고온 처리구는 18.8°C로 무처리구에 비해 4.6°C 높았다(Fig. 1). 수잉기 이후 고온처리구의 출수는 무처리구의 출수기에 비해 2일 정도 빨랐으며, 무처리구의 출수기 적산온도는 고온처리구 적산온도보다 86°C 낮았다. 그리고 수량조사날 (고온처리 50일 후) 무처리구 적산온도는 505°C, 고온 처리구 적산온도는 758°C 로 고온 처리구 적산온도가 무처리구 적산온도에 비해 높았다(Fig. 1).
고온 조건에서 잎의 생리적 변화
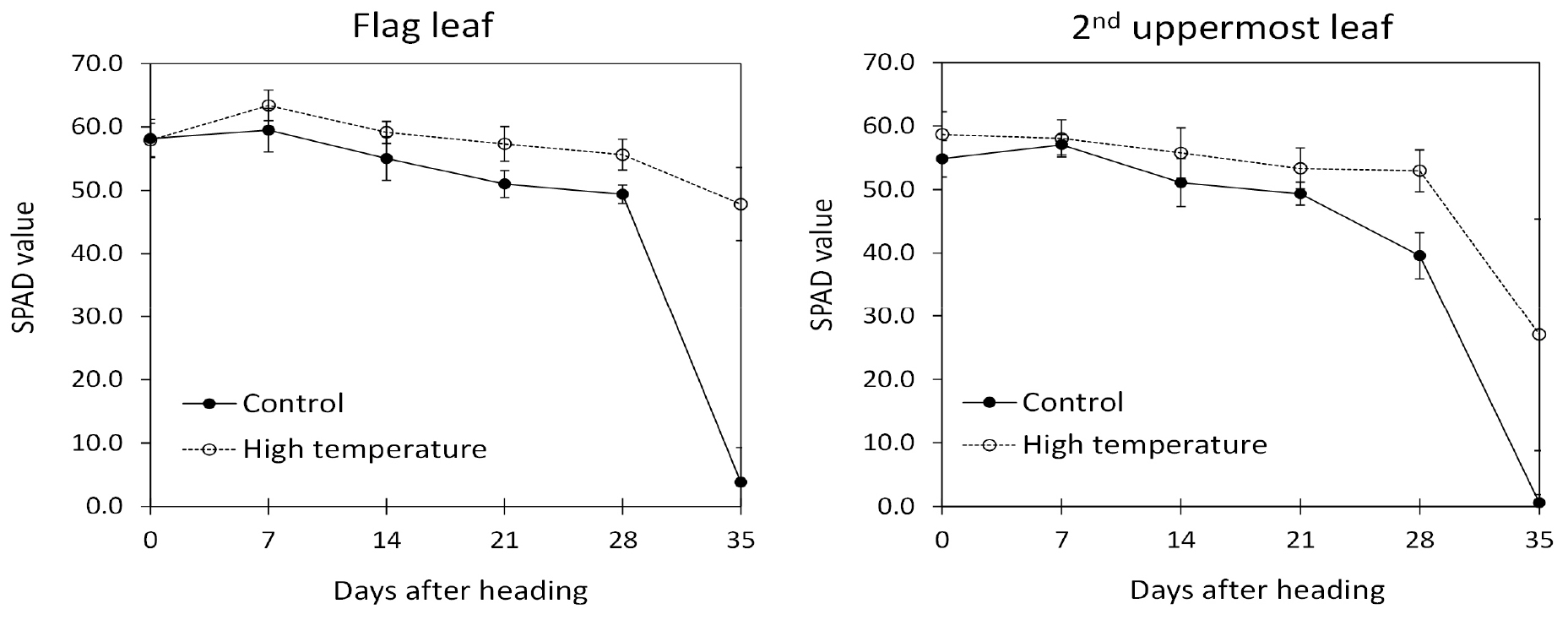
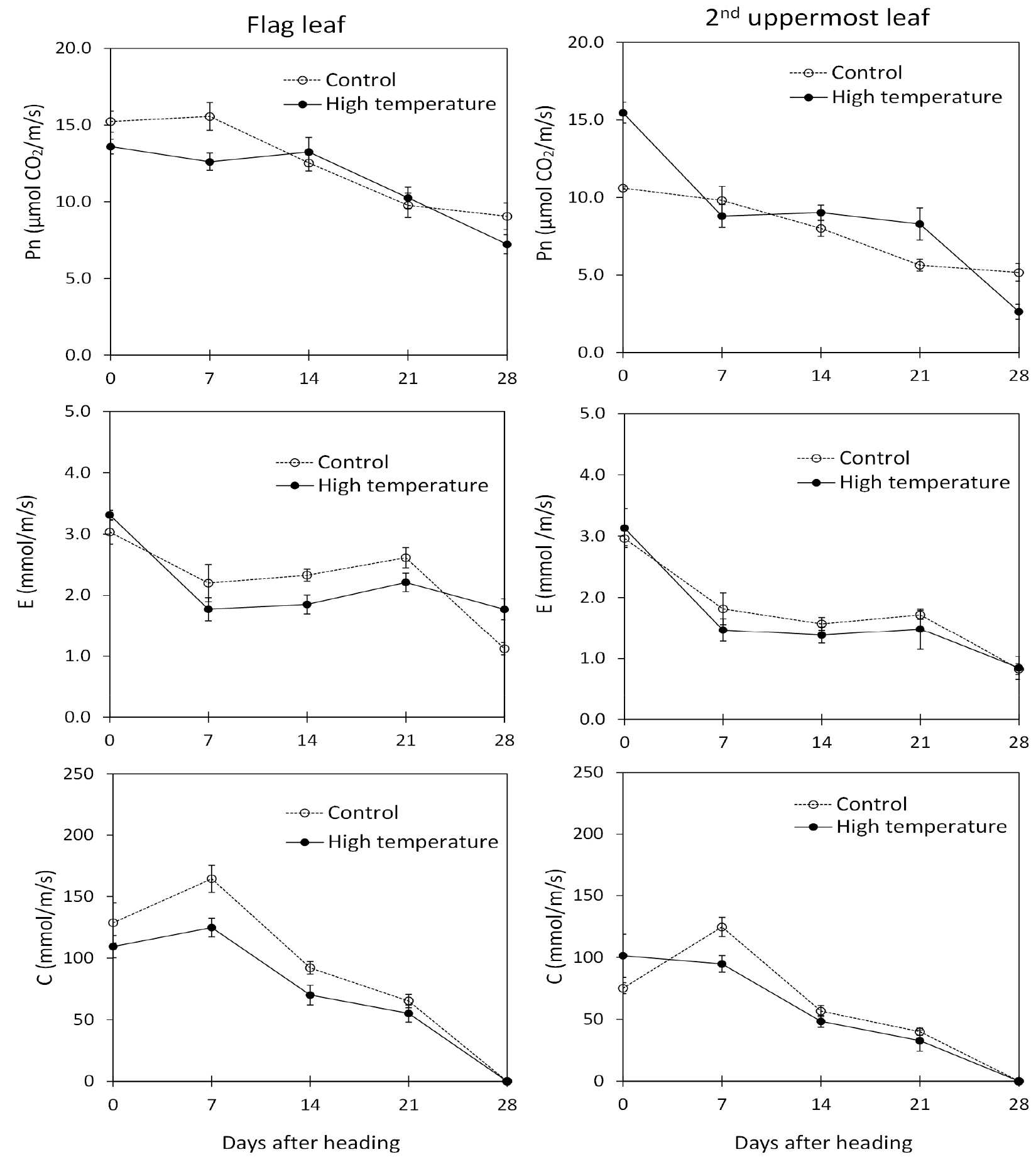
엽녹색도(SPAD value)는 고온 처리구 지엽과 최상위제2엽이 무처리구 지엽과 최상위제2엽에 비해 높은 것으로 확인되었다(Fig. 2). 특히, 출수 후 35일 무처리구 지엽과 최상위제2엽의 엽녹색도는 각각 3.8과 0.6으로 잎의 노화가 급격하게 촉진되었고, 고온처리구에서 지엽과 최상위제2엽의 엽녹색도는 각각 47.8과 27.1으로 잎의 노화가 지연된 것을 확인하였다. 광합성과 관련하여 광합성률은 출수 후 14일과 21일은 고온 처리구가 무처리구에 비해 높았으나, 그 외 조사에선 무처리구가 높았다. 지엽과 최상위제2엽의 증산율 및 기공전도도는 고온처리구가 무처리구에 비해 낮았다(Fig. 3). 이러한 결과는 무처리구 주변 온도에 비해 고온 처리구 주변 온도가 높았고(Fig. 1), 엽온도 고온 처리구가 무처리구보다 높았기 때문에 고온에 의한 잎의 수분 손실을 줄이기 위한 것으로 생각된다.
Park & Lee (2003)과 Fu et al. (2009)에 의하면, 잎의 노화가 지연되면 광합성 능력이 유지되기 때문에 종실 등숙에 긍정적으로 작용하고, 잎의 노화가 빠르면 이삭의 노화도 빨라져 등숙에 불리하다고 한다. 반면 Murchie (1999)는 벼의 등숙기간에 엽록소가 어느 정도 감소해도 광합성 능력이 유지되었기 때문에 엽록소 손실과 광합성 능력이 반드시 일치하지 않는다고 하였고, Kim et al. (2011)도 생리적 성숙기 이후에서도 잎의 노화 지연이 확인된 것으로 보아 등숙 종료의 결정적인 요인이 아니라고 하였다. 본 연구결과에서도 엽록소 함량은 고온 처리구가 무처리구에 비해 높았고 더 오래 유지되어 광합성률 또한 처리 후 2주와 3주에 높았다. 그러나 증산률과 기공전도도는 출수 이후 무처리에서 높았다. 이는 엽록소 함량에 직접 영향을 받는 광합성은 고온에 의해 높았으나 체내 수분 상태에 의한 영향을 더 받는 증산과 기공전도도는 고온에 의해 낮아졌기 때문으로 생각된다. 고온의 영향이 생육 단계 별로 다르고 기관별로도 반응이 상이하므로(Khan et al., 2020), 낮은 수준의 고온이 상위 잎에서 엽록소 함량 감소를 지연시키는 이유에 대해서는 추가적인 연구가 필요할 것으로 생각된다.
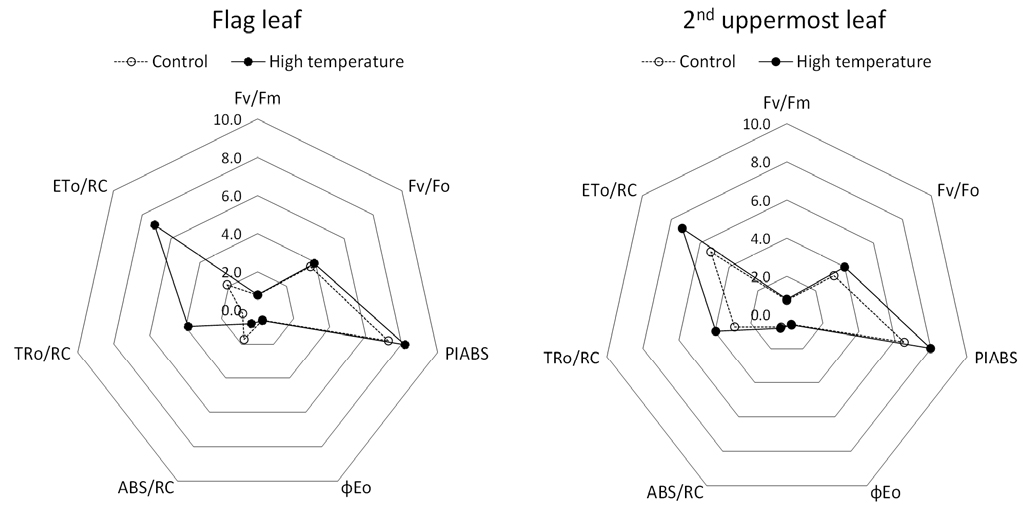
광합성 명반응의 OJIP-fluorescence은 환경적 스트레스에서 비파괴적으로 빠르게 광합성 기관(광계 II)의 상태를 평가하는 지표로, 광합성 측면에서 작물의 상태를 평가하는데 많이 활용되고 있다(Strasser et al., 2000). 본 연구의 결과, 지엽과 최상위제2엽의 광합성 능력 및 양자 수율을 나타내는 지표(Snider et al., 2018)인 Fv/Fm, Fv/Fo 및 PIABS은 고온처리구가 무처리구에 비해 높았고, 기관별로는 지엽보다 최상위제2엽이 높았다(Fig. 4). 그리고 지엽과 최상위제2엽의 ETo/RC와 TRo/RC은 광합성 기관 즉 광계 II의 구조적 상태를 나타내는 지표(Snider et al., 2018)로서 고온 처리구가 무처리구에 비해 높았고, 기관별로는 최상위제2엽보다 지엽에서 높았다(Fig. 4). 이 결과는 엽녹색도의 결과와 마찬가지로, 고온처리가 잎의 광합성 능력을 향상시켜서 잎의 노화를 지연시킨 것으로 생각된다.
지엽 온도는 출수 후 7일을 제외하고 고온 처리구가 무처리구보다 높았고, 최상위제2엽과 이삭은 고온처리구가 무처리구보다 높았다(Figs. 5, and 6). 물이 광합성을 하는 동안 잎의 기공을 통하여 많은 양의 물을 증산에 통해 잃게 되어 엽온이 낮아진다(Park, 2011). 본 연구의 결과는 고온에 노출된 잎에서 증산에 의한 냉각을 초과하는 열이 외부로부터 잎에 전달되어 각 기관의 온도를 높인 것으로 생각된다.
고온처리에 의한 종실 등숙 변화 및 수량 조사
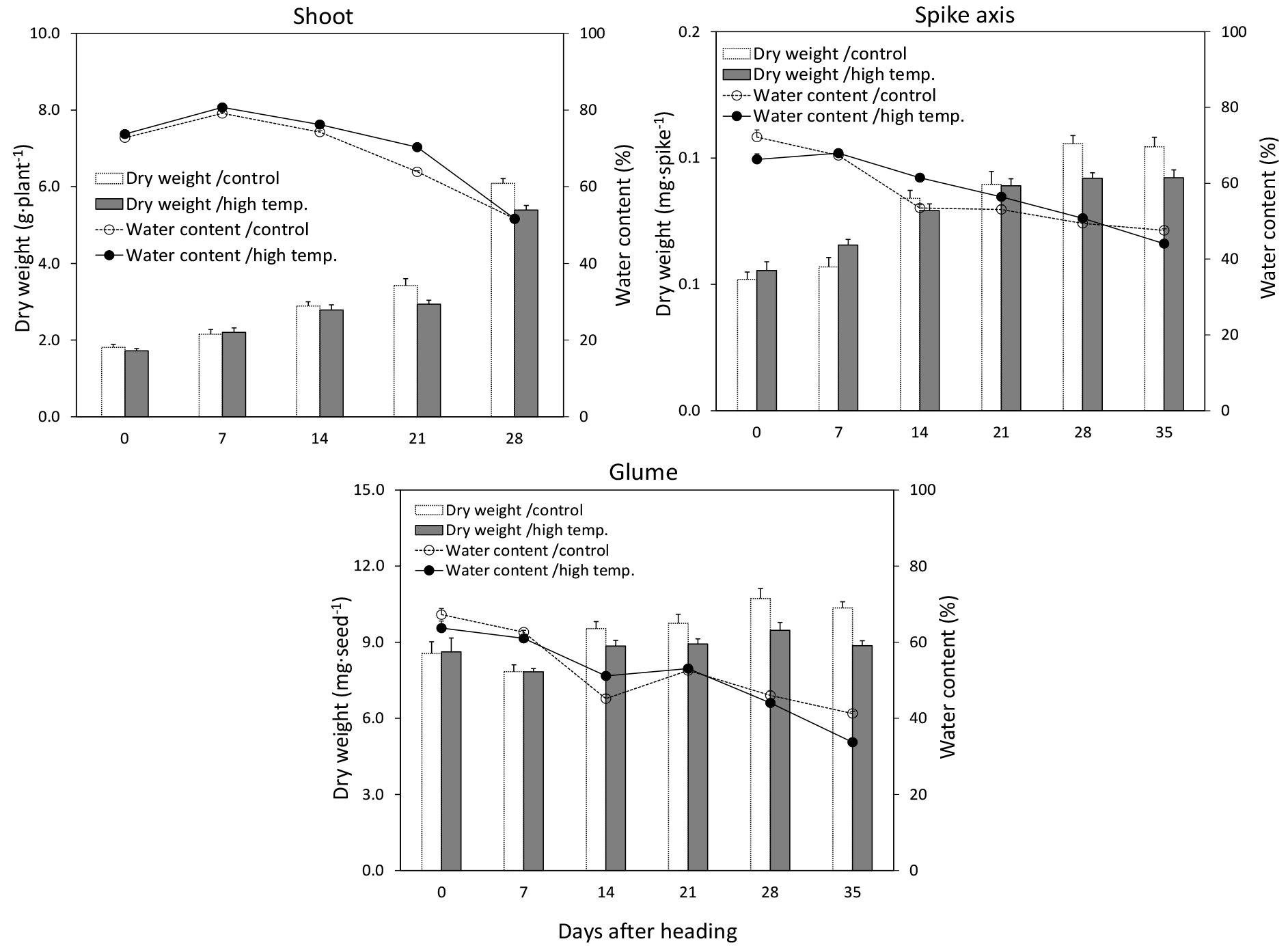
출수기 고온 스트레스는 수분(pollination)에 영향을 주어서 착립율을 감소시키고(Smika & Shawcroft, 1980), 불임을 유발한다(Saini & Aspinall, 1983). 종실의 등숙 기간에 고온은 광합성 능력을 감소시키고, 잎의 노화 촉진을 유발하여 종실로의 동화산물 이동을 감소시킨다(McDonald & Paulsen, 1997). 따라서 본 연구에서는 수잉기 고온처리에 의한 종실 생장 변화를 확인하기 위해서 광합성 동화산물 공급부위(지상부, 이삭축과 영)의 건물중과 수분함량, 광합성 산물 수용부위(종실과 종실을 포함한 이삭)의 건물중과 수분함량을 비교해 보았다(Figs. 7, and 8).
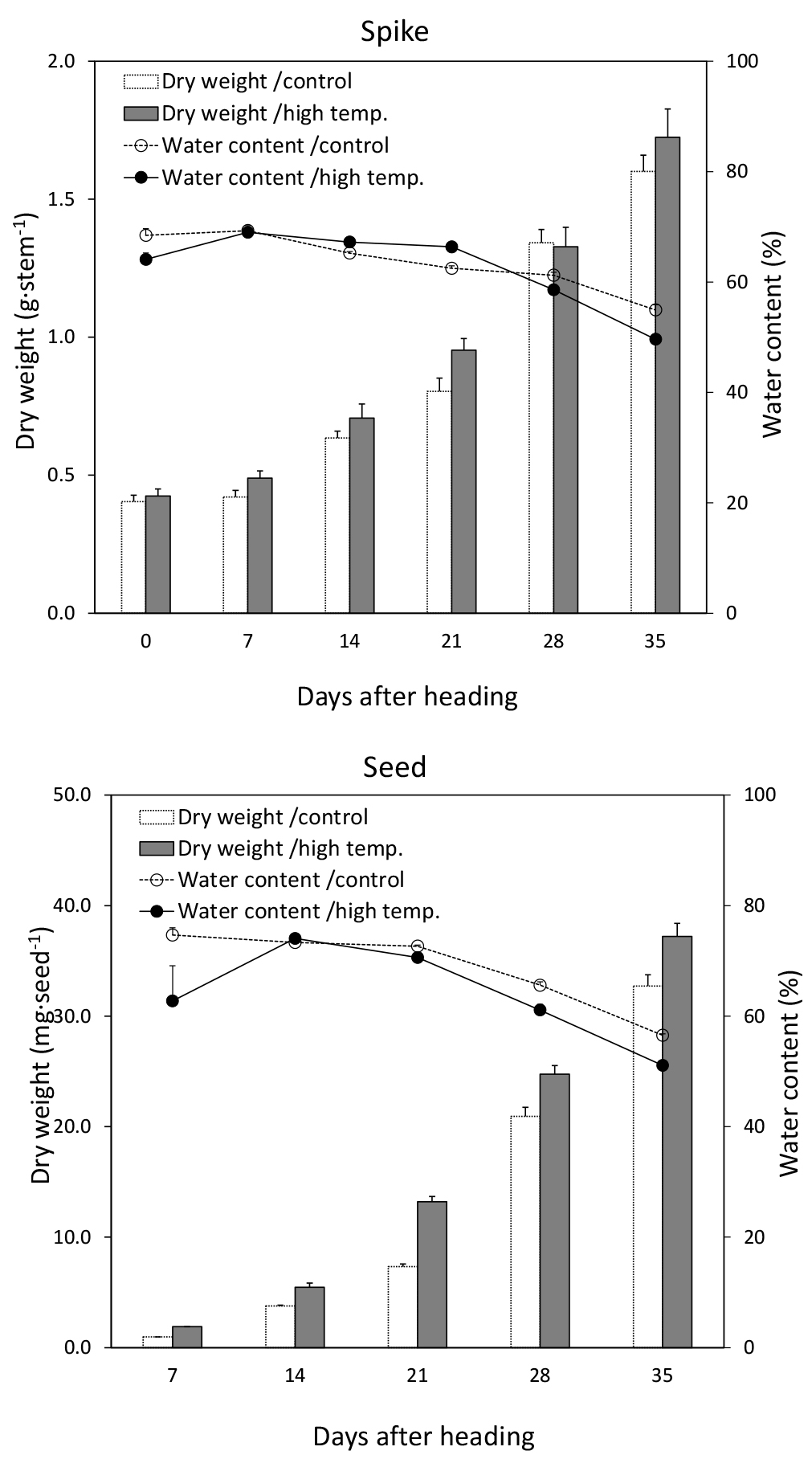
지상부 건물중은 출수 후 7일을 제외하고는 무처리구가 고온처리구에 비해 높았지만, 지상부의 수분함량은 고온 처리구가 무처리구보다 높았다(Fig. 7). 이삭의 건물중은 고온 처리구가 무처리구에 비해 높았지만, 이삭의 수분함량은 출수 후 7일부터 21일을 제외한 조사일엔 무처리구가 고온처리구보다 높았다(Fig. 8). 이러한 결과는 작물 체내 동화물질 공급부위로서 지상부는 무처리구가 고온처리구보다 높았지만, 수용부위인 이삭으로의 물질 재분배는 고온처리구가 무처리구보다 더 많이 진행된 것으로 생각된다. 종실 건물중도 고온처리구가 무처리구보다 시간이 지남에 따라 점점 높아졌으나, 종실의 수분함량은 출수 후 7일을 제외하고는 고온처리구보다 무처리구에서 높았다(Fig. 8). 특히 고온처리구의 수분함량은 출수 후 14일에 가장 높은 값을 보인 무처리구에 비해 빠르게 감소하였다.
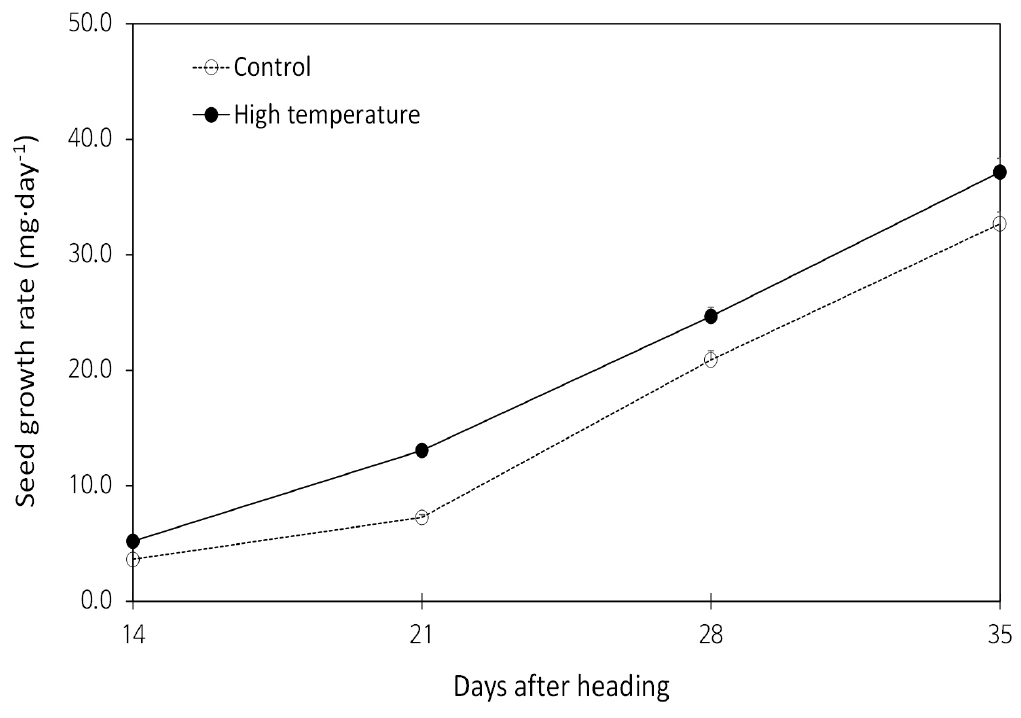
이삭축과 영의 건물중은 출수 후 7일까지는 고온처리구가 무처리구에 비해 높았으나, 등숙이 진행됨에 따라 무처리구가 고온처리구보다 높았다. 수축 수분함량은 출수 7일 후부터 28일까지는 고온처리구가 무처리구보다 높았고, 영 수분함량은 출수 후 14일과 21일에 고온처리구가 무처리구보다 높았다(Fig. 7). Zhang et al. (2018)은 벼에서 출수기 때 고온처리는 지엽의 광합성에는 영향을 끼치지 않았지만, 동화산물 분배에 제한을 주어 종실중이 감소했다고 하였다. 광합성 산물의 공급부위와 수용부위의 건물중과 수분함량 결과를 본 결과, 고온처리가 동화산물 분배에 긍정적인 효과를 준 것으로 보여진다. 즉, 수잉기 고온처리가 줄기에서 이삭 및 종실로의 동화산물 전류를 촉진해 건물중을 증가시켰고, 종실을 제외한 나머지 기관의 수분함량도 전류물질과 함께 이삭으로 빠르게 이동하였기 때문에 무처리구에 비해 높아진 것으로 보인다. 고온처리가 전류 속도가 증가하여 종실 생장률도 무처리구보다 고온처리구가 높았고(Fig. 9). 기후 변화에 의한 고온 발생은 그 정도에 의해 나타나는 영향의 차이가 있으며(Khan et al., 2020), 낮은 수준의 고온은 출수 이후 등숙 속도와 종실축적을 개선하나 높은 고온은 등숙률과 종실축적을 저해하는 부정적인 영향이 크다(Sofield et al., 1977; Dias & Lidon, 2009). 본 연구에서 등숙기간동안 무처리 대비 4°C 높은 고온의 경우 부정적인 영향보다 긍정적인 효과를 보여 수확기에 10a 당 이삭중 및 종실수량은 고온처리구가 무처리구보다 높은 것으로 나타났다(Table 1).
Table 1.
Yield-related characteristics of wheat grown under ambient and elevated temperatures (P < 0.05).
|
No. of spike (No.・10a-1) |
Spike weight (kg・10a-1) |
Yield (kg・10a-1) |
1000 seeds weight (g) | |
| Control | 450a | 766b | 510b | 50a |
| High temperature | 510a | 974a | 689a | 47b |
초분광 분석을 통한 기관별 식생지수
고온처리에 의한 기관(지엽, 최상위제2엽 및 이삭)별 생리적 형질들을 비교하기 위해서 출수기부터 생리적 성숙기(출수 후 35일)까지 400~1000 nm의 초분광 반사율을 이용하여 주요 식생지수들을 추출하였다(Tables 2, 3, and 4). 지엽의 식생지수들 분석 결과(Table 2), 엽록소 함량과 관련된 식생지수인 NDVI, SRI, GNDVI, PSSRa, PSSRb은 출수 후 7일까지는 무처리구가 고온처리구에 비해 높았지만, 시간이 지남에 따라 고온처리구가 높아졌다. 잎의 질소 상태를 파악하는 식생지수인 RI와 PhRi는 잎의 질소가 낮아지면 높아지는 경향이 있는데 이 지수들은 고온처리구가 무처리구보다 낮았기 때문에 지엽의 질소 상태는 고온처리구에서 양호한 것으로 생각된다.
Table 2.
Vegetation indices calculated based on the spectral reflectance of the flag leaf.
NDVI1 - (R800-R680)/(R800+R680), Re-NDVI2 - (R750-R710)/(R750+R710), MRE NDVI3 - (R750-R705)/(R750+R705-2*R445), NRI4 - (R570-R670)-(R570+R670), GI5 - R570/R670, SRI6 - R900/R680, GNDVI7 - (R750-R550)/(R750+R550), VOG REI18 - R740-R720, PRI9 - (R531-R570)/(R531+R570), PSRI10 - (R680-R500)/R750, SIPI11 - (R800-R445)/(R800+R680), BI12 - R450/R490, PSSRa13 - R800/R680, PSSRb14 - R800/R635, PSSRc15 - R800/R500, CI16 - R515/R570, RI17 - R700/R670, PhRi18 - (R550-R531)/(R550+R531), GCI19 - (R780-R550)-1.
최상위제2엽의 엽록소 함량과 관련된 식생지수들 중에 NDVI와 GNDVI는 고온 처리구가 무처리구보다 높았다. Zhan et al. (2008)에 의하면 엽록소 색소와 Chl a/b, Chl/Car은 식물의 스트레스 및 내성을 나타내는 지표라고 하였다. 따라서 카로티노이드계 색소와 엽록소 비율을 보여주는 식생지수들인 SRI와 PSSRa는 출수 후 14일까진 무처리구가 낮았으나 그 이후에는 고온처리구에서 낮은 것으로 보아서, 무처리구의 최상위제2엽이 고온에 민감한 것으로 판단된다(Table 3).
Table 3.
Vegetation indices calculated based on the spectral reflectance of the second uppermost leaf.
이삭의 녹색도는 기관의 형태적 특성상 접촉형 기기를 이용한 측정이 어렵지만, 초분광 분석을 활용한 식생지수 분석으로 비파괴적 방법으로 평가가 가능하다. 본 연구에서는 지엽과 최상위제2엽의 식생지수들에 비해 이삭의 녹색도가 낮은 것으로 확인되었다(Table 4). 한편 광이용 효율과 관련된 이삭의 PRI는 출수 후 7일에 높았는데 지엽과 최상위제2엽도 출수 후 7일에 높은 것으로 나타났다(Tables 2, 3, 4). 이 결과는 출수 후 7일 지상부 건물중과 수분함량, 수축 건물중 및 종실 수분함량의 결과와 유사하였다. 고온은 생육 기간을 단축시키는 부정적인 영향이 있지만 등숙기간 중 고온은 등숙속도와 종실축적률에 긍정적인 면도 있어 생육 저해를 상쇄하는 효과도 있으며(Sofield et al., 1977), 고온의 정도에 따라 그 영향이 다르므로(Khan et al., 2020), 고온 발생 시기와 고온 정도에 따라 종실에 미치는 영향이 달라지는 것으로 생각된다.
Table 4.
Vegetation indices calculated based on the spectral reflectance of spike.
적 요
고온처리가 동화산물의 공급부위인 잎과 수용부위인 종실에 미치는 영향과 그에 따른 기관별 초분광 분석에 의한 식생지수들을 비교해 보았다.
1. 출수 후부터 생리적 성숙기까지 지엽과 최상위엽의 엽녹색도에선 고온처리구가 무처리구보다 높은 값으로 유지되었고, 광합성 성능 지수 및 OJIP-derived parameter에서도 고온처리구 잎이 무처리구 잎보다 높았다. 본 연구 결과, 수잉기 후 고온처리는 잎의 노화를 지연시켰고, 광계Ⅱ의 능력을 증가시켰다. 지엽과 최상위제2엽의 광합성률은 고온처리구가 무처리구에 비해 저하가 늦게 시작되었다. 증산율과 기공전도도는 고온처리구 잎이 무처리구 잎에 비해 낮았다.
2. 출수 초기에 동화산물 공급부위인 지상부와 이삭축, 영의 건물중은 고온처리구가 무처리구에 비해 높았지만, 시간이 지남에 따라 고온처리구보다 무처리구에서 높았다. 싱크기관인 이삭과 종실의 무게는 고온처리구가 무처리구보다 높았고, 종실 생장률도 고온처리구가 무처리구보다 높았다.
3. 지엽과 최상위엽의 식생지수들 중 엽록소 함량과 잎의 질소 상태와 관련된 식생지수들은 시간이 지남에 따라 고온처리구가 무처리구보다 높아졌고, 광효율과 관련된 PRI은 출수 후 7일부터 무처리구보다 고온처리구에서 높아지기 시작했다. 출수 후 7일에 지상부 건물중과 수분함량, 이삭축 건물중 및 종실 수분함량도 같은 결과를 보였다.