서 론
재료 및 방법
식물재료
온도 및 CO2 조건별 잡초 생장반응
온도 및 CO2 조건별 제초제 약효반응
온도 및 CO2 조건별 콩 약해 반응
통계처리
결과 및 고찰
온도 및 CO2 조건별 잡초 생장 반응
온도 및 CO2 조건별 제초제 약효반응
온도 및 CO2 조건별 콩 약해 반응
적 요
서 론
기후변화는 온도와 이산화탄소 상승 등과 같은 여러 요인에 의해 농업부문 등 다양한 부문에 영향을 미치고 있다(Dai et al., 2013; Hatfield et al., 2011; Seneviratne et al., 2012). 특히, 기후변화는 작물의 생육 및 재배환경에 변화를 불러일으키고 있으며, 결과적으로 작물 생산에 중대한 영향을 미친다. 또한 기후변화로 인하여 온도와 이산화탄소 농도뿐만 아니라 강수량의 변화는 잡초의 생육과 번식 주기를 변경시키고, 발생량과 확산에 영향을 주어 궁극적으로 작물의 생산성에 영향을 미친다(Ainsworth & Long, 2005; Bradley et al., 2010; Lobell et al., 2008; Ramesh et al., 2017; Ziska et al., 2011). 또한 기후변화에 의해 온도가 증가하면 광합성 속도가 변화하게 되고, 이산화탄소 농도 상승은 광합성 효율성을 증가시켜 결과적으로 이러한 변화는 작물의 재식밀도에 영향을 미친다(Al-Johani et al., 2012; Lobell & Gourdji, 2012; Won et al., 2011). 따라서 기후변화는 기존의 잡초 관리 방법과 작물 재배 기술 등 새로운 관리 시스템 개발이 필요로 할 것이다.
농약은 작물 생산의 안정성과 생산성을 유지하는 데 있어서 중요한 역할을 담당하고 있다(Bridges, 2008). 그중 제초제는 잡초를 제거하여 작물이 생산성을 향상시키는데 필수적인 농약이다. 그러나 기후변화로 인해 제초제의 약효와 약해가 변화될 수 있어 기존의 제초제 사용 방법이 더 이상 유효하지 않을 수 있다는 우려가 제기되고 있다. 예를 들어, 기온 상승과 이산화탄소 농도가 증가함에 따라 잡초의 생육을 촉진시키고, 제초제의 약효와 작물 약해에 영향을 미칠 가능성이 있다(Ainsworth & Long, 2005; Dukes & Mooney, 1999; Long et al., 2006; Ziska & McConnell, 2016). 또한 이산화탄소, 온도와 같은 환경요인의 변화는 식물체 내의 제초제 침투와 이행의 변화, 제초제 내성, 식물의 생장과 생리적 특성을 변화시켜 식물과 제초제 사이의 상호작용에 영향을 미친다(Aruna & Jugulam, 2016; Kudsk & Kristensen, 1992).
콩은 우리나라의 대표적인 밭작물로써 1모작 재배 시에는 파종 시기가 빠르고 생육 시기가 길어 잡초와의 경합 기간이 길어 상대적으로 잡초 방제는 매우 어려운 실정이다(Song et al., 2009). 또한 콩밭에서 잡초에 의한 피해는 발생 잡초종에 따라 다르나 심할 경우 90% 이상의 콩 수량 감소를 보이기도 한다(Jang & Kuk, 2020; Jang et al., 2019; Song et al., 2010). 콩 밭에 우점하는 잡초중의 하나인 깨풀은 전국의 밭과 밭둑에서 발생하는 동아시아 원산의 대극과 1년생 초본으로 제초제 내성이 강하고 작물의 생육 기간인 봄부터 여름까지 발생하며 콩밭에서 경합해를 일으키는 문제 잡초이다(Yoo et al., 2012). 한 예로 깨풀이 m2당 4본 발생하였을 때 콩의 수량은 완전방제구에 비해 11% 감소되었다.
따라서 본 연구의 목적은 기후변화에 의한 대기온도와 이산화탄소 농도 증가로 잡초인 깨풀 생육 차이와 주요 경엽 및 토양처리제 제초제에 각각 4종에 대한 잡초 약효와 콩 약해 반응 차이를 확인하여 새로운 잡초 관리 방법을 개발하기 위한 기초적인 자료로 활용하고자 하는 데 있다.
재료 및 방법
식물재료
본 연구에서 사용한 깨풀(Acalypha australis)과 명아주(Chenopodium album)는 2021년 순천대학교 서면농장에서 채취하여 실험에 이용하였다. 채취한 종자는 실험에 사용하기 전까지 4°C 냉장고에 보관하였다. 콩은 2022년에 순천대학교 서면농장에서 재배하여 수확한 콩(Glycine max; 품종, 대찬) 종자를 사용하였다.
온도 및 CO2 조건별 잡초 생장반응
온도 조건별 깨풀의 생장을 알아보기 위하여 원형 컵포트(195 ml)에 순천대학교 서면농장에서 채취한 흙을 채운 후 깨풀 종자를 각각 15립씩 파종하여 각각 온도가 20°C, 25°C 및 30°C로 항온으로 유지되는 생장상(Multi-room Incubator, VS-1203PFC-LN, Vision Bionex, Buchon, Korea)에 두었다. 파종 후 32일에 초장 및 생체중을 조사하였다. 또한 사각포트(18 cm × 13 cm)에 깨풀 종자를 각각 20립 파종한 후 실험 기간의 일 평균온도가 19°C, 23°C 및 27°C 조건으로 유지되는 온실상에 두었다. 실험기간 일 평균온도는 온도 측정기(SK-L200THα, SATO, Tokyo, Japan)을 이용하여 측정하였다. 생장상 실험과 동일하게 파종 후 32일에 초장과 생체중을 조사하였다.
위의 온도별 실험과 유사한 방법으로 CO2 농도별로 깨풀 생장을 알아보기 위하여 사각포트에 깨풀 종자를 파종한 후 온도가 25°C로 일정하게 유지되는 CO2 생장상(HB-303DH-O, HANBAEK SCIENTIFIC, Korea)에 각각 400 ppm과 800 ppm으로 농도를 조정하였다. 파종 후 17일에 발아율, 초장, 생체중, 엽면적(Area Meter, LI-3100C, LI-COR, USA) 및 광합성효율(PAM-2500 Heinz Walz GmbH, Effeltrich, Germany)을 조사하였다.
온도 및 CO2 조건별 제초제 약효반응
위의 잡초 생장반응 실험과 동일하게 깨풀 종자를 파종하여 생장상(항온; 20°C, 25°C 및, 30°C)과 온실상(변온; 21°C, 25°C 및 29°C)에서 실험하였다(Fig. 1). 사용된 제초제는 토양처리 제초제 4종(alachlor, metolachlor, ethalfluralin 및 linuron)과 경엽처리 제초제 4종(glyphosate-isopropylamine, glufosinate-ammonium, bentazone 및 mecoprop)을 사용하였다. 제초제와 처리량 등의 정보는 Table 1과 같다. 경엽처리 제초제의 경우 파종 후 30일(3~4엽기)에 처리하였고, 토양처리 제초제의 경우는 파종 후 3일에 처리하였다. 처리 후 29일에 지상부 생체중을 조사하였고, 무처리 대비 지상부 생체중으로 방제가를 산출하였다. 그 외 방법은 위의 잡초 생장반응 실험과 동일하게 수행하였다.
온도에 의한 제초제 약효반응과 유사하게 생장상 온도는 25°C로 조절하여 CO2 농도를 각각 대기 평균 농도인 400 ppm과 대기의 2배 농도인 800 ppm으로 설정하여 CO2 조건하에서 제초제 약효 반응 실험수행 하였다. 토양과 경엽처리 제초제를 처리 후 14일에 초장 및 생체중을 조사하였고, 무처리 대비 생체중으로 방제가를 산출하였다. 그 외 실험방법은 온도에 의한 제초제 약효 반응과 동일하게 수행하였다.
Table 1.
Details of herbicides used in this study.
온도 및 CO2 조건별 콩 약해 반응
위의 온도 및 CO2 실험과 유사하게 온도와 CO2 농도별 실험을 수행하였다. 제초제의 경우는 콩 재배지에 사용할 수 있는 토양처리 제초제 4종(alachlor, metolachlor, ethalfluralin, linuron)을 파종 후 3일 뒤 처리하였다. 처리 후 7일 뒤 지상부 생체중을 조사하여 무처리 대비 콩의 약해를 산출하였다. 그 외 실험방법은 온도에 의한 제초제 약효 반응과 동일하게 수행하였다.
통계처리
본 연구는 완전임의배치 3반복으로 하였으며, 연구결과는 통계분석 Duncan’s Multiple Range Test (P=0.05)을 이용하여 유의성 검정을 하였다(SAS, 2000).
결과 및 고찰
온도 및 CO2 조건별 잡초 생장 반응
온도 변화에 따른 깨풀의 생장 반응을 조사하기 위해 온도가 일정하게 유지되는 생장상과 온도가 변화하는 온실상에서 생장한 후 초장 및 지상부 생체중을 조사하였다(Fig. 2). 생장상의 온도가 높을수록(20°C, 25°C 및 30°C) 깨풀의 초장 및 생체중이 증가하였다. 또한 온실의 온도가 높을수록(19°C, 23°C 및 27°C) 깨풀의 초장 및 생체중이 증가하였다. 일반적으로 온도에 따른 잡초의 생장은 잡초 종마다 다르게 나타날 수 있으나, 일반적으로 온도가 높은 조건하에서 개화기와 종자를 형성하는 시기가 빨라 짐을 확인할 수 있었다(Lee, 2011; Nguyen et al., 2017). 다른 연구에서도 온도가 14°C에서 4°C 증가함에 따라 명아주의 출현 시기는 약 26일, 개화 시기는 약 50일 정도 빨라졌다(Lee, 2011). 또한 Nguyen et al. (2017)의 연구에서도 Parthenium hysterophorus는 30/15°C (주/야)보다 상대적으로 온도가 높은 35/20°C (주/야)에서 더 빨리 생장하고 건물중이 높을 뿐만 아니라 개화가 빠르고 종자를 많이 형성하였다.
25°C로 온도가 일정하게 유지되는 생장상에서 CO2 농도를 대략적으로 대기의 평균 농도인 400 ppm과 그 두배량인 800 ppm으로 설정한 후에 발아율, 초장, 엽면적 및 지상부 생체중을 조사하였다(Fig. 3). 깨풀의 발아율은 CO2 400 ppm과 800 ppm간에 유의적인 차이가 없었다. 그러나 초장은 CO2 농도가 높은 800 ppm에서 400 ppm에 비해 유의적으로 컸다. 또한 엽면적과 지상부 생체중은 CO2 농도가 높은 800 ppm에서 400 ppm에 비해 약 3.6배 높았다. 광합성 효율(Fv/Fm)은 두 농도간에 유의적인 차이가 없었고, ETR값의 경우 일부 광량에서 800 ppm에서 400 ppm에 비해 높았으나 일반적으로 두 농도간에는 유의적인 차이가 없었다(Fig. 4).
이산화탄소의 농도 증가는 Commelina diffusa, Euphorbia geniculata와 Ligustrum sinense종에서 더 많은 분지가 생산되었고, 광합성 속도 또한 빨라졌다(Awasthi et al., 2018). Parthenium hysterophorus을 대상으로 한 실험에서도 대기 평균 농도인 400 ppm일 때 보다 높은 농도인 700 ppm에서 엽수, 초장 및 건물중이 높았다(Bajwa et al., 2019). 또한 온도와 이산화탄소 둘 다 증가했을 때 Chenopodium album의 생체중은 34%, 종자량은 114%로 현저하게 증가하였다(Lee, 2011). 따라서 온도와 이산화탄소 농도 변화에 따른 잡초종의 생장량 차이 뿐만 아니라 제초제에 대한 약효 차이가 예상되어 아래 실험을 수행하였다.
온도 및 CO2 조건별 제초제 약효반응
깨풀에 4종의 경엽처리 제초제(glyphosate, glufosinate, mecoprop 및 bentazone)를 처리 후 20°C, 25°C 및 30°C로 설정된 생장상에 두었을 때 glyphosate 처리 약량(표준량 및 표준량의 1/2량)에 상관없이 깨풀의 방제가는 온도간에 유의적인 차이가 없었다(Fig. 5). Glufosinate를 표준량 처리했을 때는 온도간에 차이가 없었으나, 1/2량을 처리했을 때 20°C 및 25°C보다 상대적으로 온도가 높은 30°C에서 약효가 감소하였다. 그러나 bentazone과 mecoprop를 처리했을 때 표준량과 1/2량 처리에서 25°C 및 30°C에 비해 낮은 온도인 20°C에서 약효가 유의적으로 낮아서 제초제 종류별 온도에 대한 약효 반응이 다름을 확인하였다.
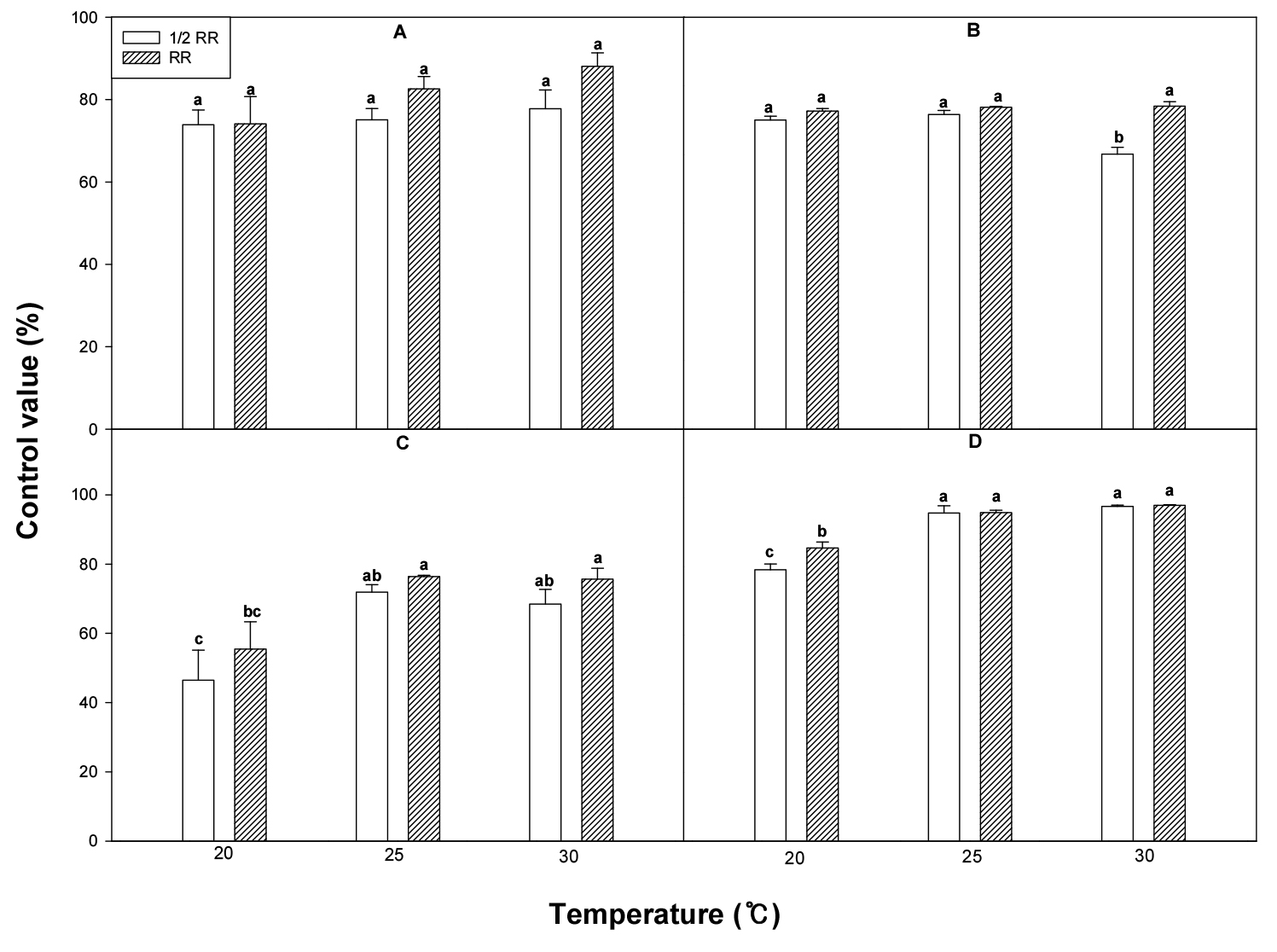
Fig. 5.
Acalypha australis control value (%) in response to various foliar herbicides (A, Glyphosate-isopropylamine; B, Glufosinate-ammonium; C, Bentazone; D, Mecoprop) at different growth chamber temperatures (RR: recommended rate; 1/2 RR: 1/2 of the recommended rate). Means within bars followed by the same letters are not significantly different at the 5% level according to Ducan’s Multiple Range Test.
깨풀에 경엽처리 제초제를 처리 후 일평균온도가 21°C, 25°C 및 29°C인 온실상에 두었을 때 glyphosate의 경우 상대적으로 온도가 낮은 21°C에서 상대적으로 온도가 높은 25°C와 29°C에 비해 약효가 낮았다(Fig. 6). Glufosinate의 경우 표준량을 처리했을 때는 온도에 따른 약효차이가 없었으나, 1/2량을 처리했을 때 상대적으로 높은 온도인 29°C에서 21°C와 25°C에 비해 약효가 감소하였다. Bentazone를 표준량 처리했을 경우는 25°C에 비해 21°C와 29°C에서 약효가 낮았고, 1/2량을 처리했을 때는 29°C에서 21°C와 25°C에 비해 약효가 낮았다. Mecoprop를 표준량과 1/2량을 처리했을 때 온도가 낮을수록 약효는 낮았다.
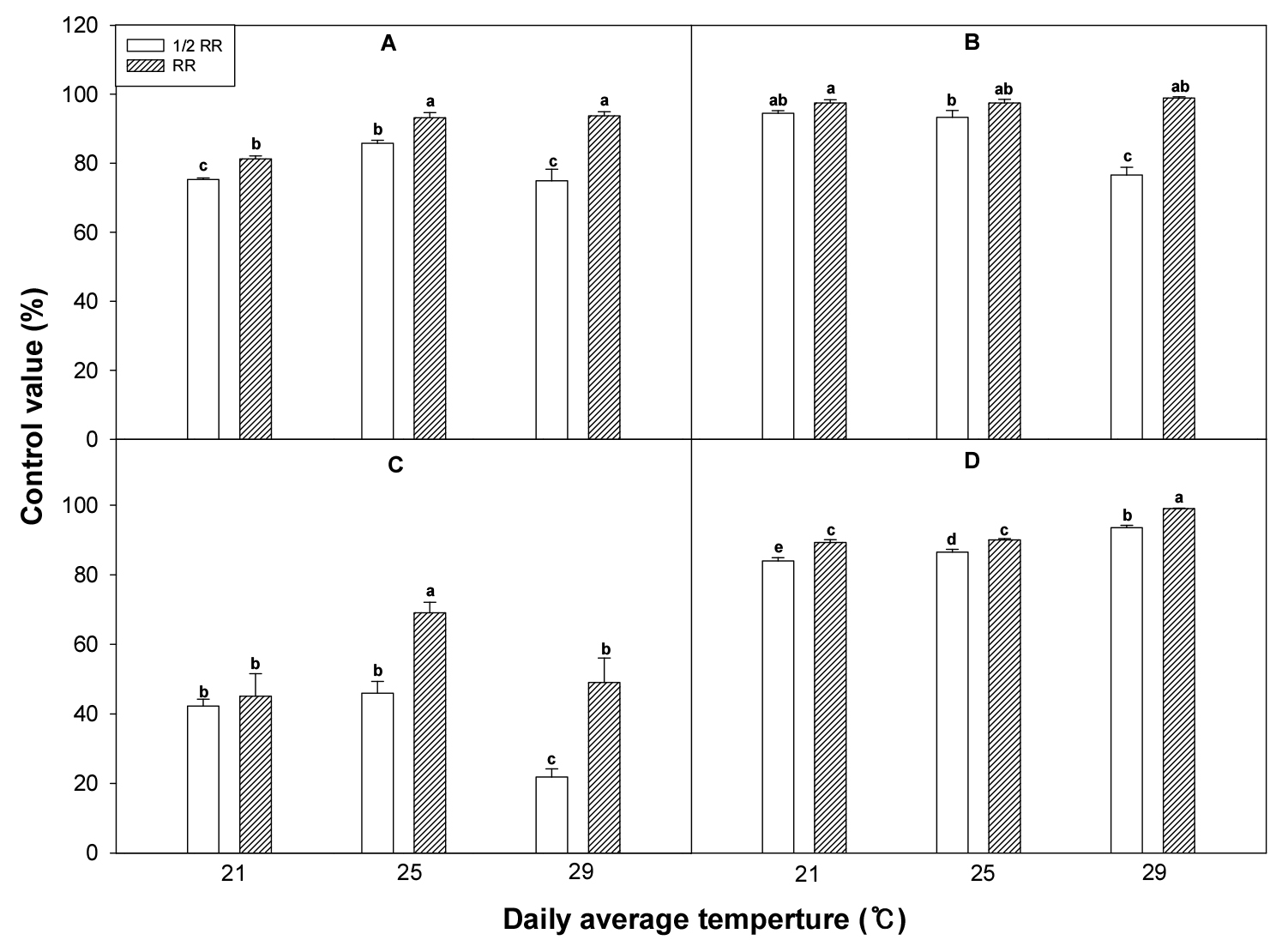
Fig. 6.
Acalypha australis control value (%) in response to various foliar herbicides (A, Glyphosate-isopropylamine; B, Glufosinate-ammonium; C, Bentazone; D, Mecoprop) at different greenhouse temperatures (RR: recommended rate; 1/2 RR: 1/2 of the recommended rate). Means within bars followed by the same letters are not significantly different at the 5% level according to Ducan’s Multiple Range Test.
깨풀에 4종의 토양처리 제초제(alachlor, metolachlor, ethalfluralin 및 linuron)를 처리 후 20°C, 25°C 및 30°C의 생장상에 alachlor를 표준량 처리했을 때 온도에 따라 약효는 유의적인 차이가 없었으나, 1/2량을 처리했을 때는 30°C에 비해 20°C 및 25°C에서 유의적으로 약효가 낮았다(Fig. 7). Metolachlor의 경우 표준량과 1/2량을 처리했을 때 25°C 및 30°C에 비해 20°C에서 약효가 낮았다. Ethalfluralin를 표준량 처리했을 때 온도간에 약효는 유의적인 차이가 없었으나, 1/2량을 처리했을 때는 25°C 및 30°C에 비해 20°C에서 약효가 낮았다. Linuron을 표준량과 1/2량을 처리했을 때는 온도에 따른 약효는 차이가 없었다.

Fig. 7.
Acalypha australis control value (%) in response to various soil herbicides (A, Alachlor; B, Metolachlor; C, Ethalfluralin; D, Linuron) at different growth chamber temperatures (RR: recommended rate; 1/2 RR: 1/2 of the recommended rate). Means within bars followed by the same letters are not significantly different at the 5% level according to Ducan’s Multiple Range Test.
깨풀에 토양처리 제초제를 처리 후 일 평균온도가 19°C, 23°C 및 27°C로 조절된 온실상에 두었을 때 alachlor를 표준량 처리했을 경우 상대적으로 온도가 높은 27°C에서 19 및 23°C에 비해 약효가 낮았으나, 1/2량을 처리했을 때는 온도에 따라 약효는 차이가 없었다(Fig. 8). Metolachlor의 경우 표준량을 처리했을 때는 온도에 따른 약효 차이가 없었으나, 1/2량을 처리했을 때는 23°C 및 27°C이 비해 19°C에서 약효가 낮았다. Ethalfluralin를 표준량 처리했을 때 온도에 따라 약효는 차이가 없었으나, 1/2량을 처리했을 때는 27°C에 비해 19°C 및 23°C에서 약효가 낮았다. Linuron을 처리했을 때는 표준량에서는 온도에 따른 약효 차이가 없었으나, 1/2량을 처리하였을 때 19°C 및 27°C에 비해 23°C에서 약효가 낮았다. 본 연구결과로 볼 때 상대적으로 온도가 높은 조건하에서 제초제 약효는 glufosinate, bentazone, alachlor 및 ethalfluralin 등에서 감소하였다. 반대로 상대적으로 온도가 낮은 조건하에서 제초제 약효는 glyphosate, mecoprop 및 metholachlor 등에서 감소하였다.
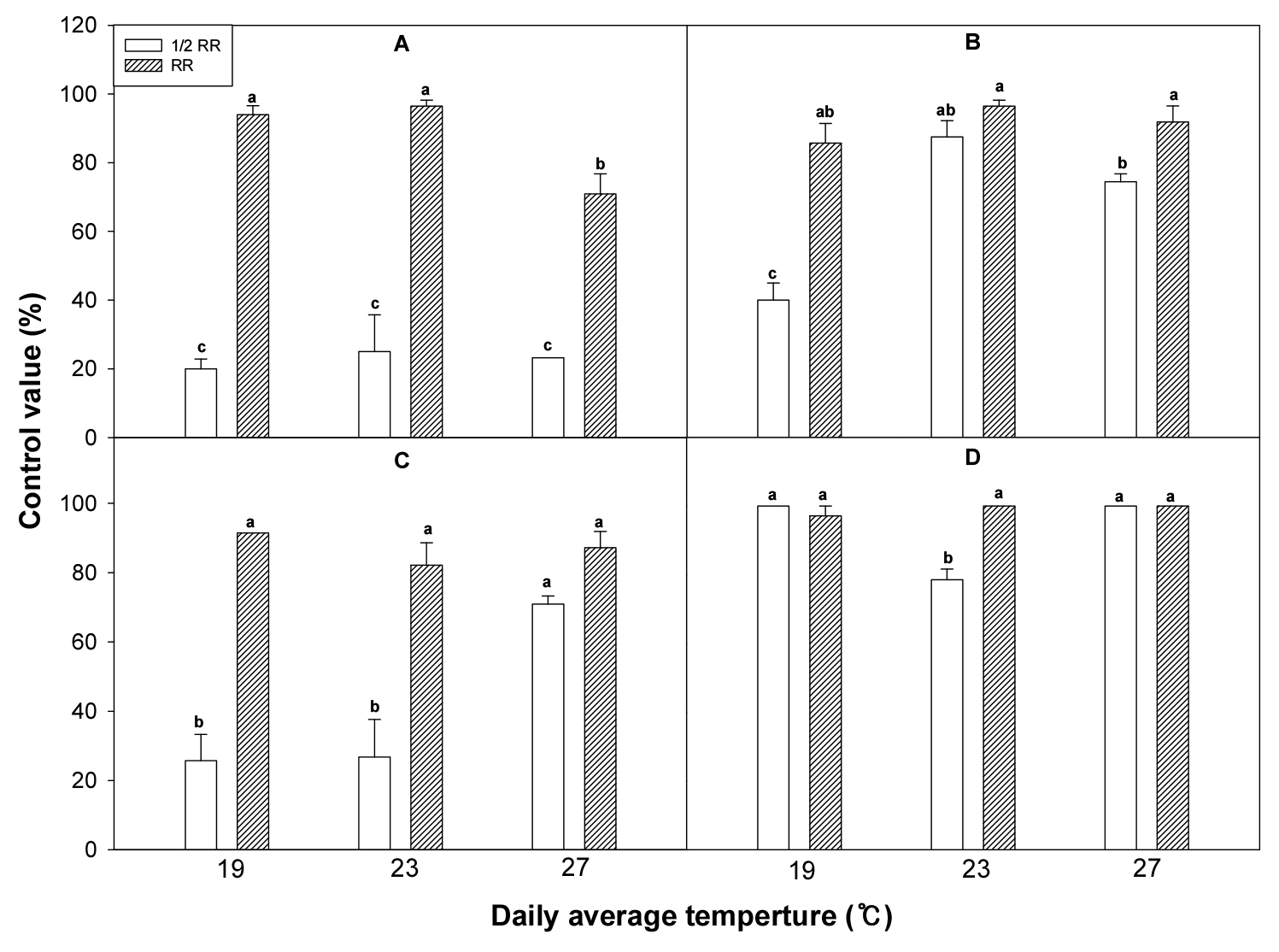
Fig. 8.
Acalypha australis control value (%) in response to various soil herbicides (A, Alachlor; B, Metolachlor; C, Ethalfluralin; D, Linuron) at different greenhouse temperatures (RR: recommended rate; 1/2 HR: 1/2 of the recommended rate). Means within bars followed by the same letters are not significantly different at the 5% level according to Ducan’s Multiple Range Test.
고온은 제초제의 흡수, 대사, 휘발성 등에 영향을 미치며 대상잡초에 대한 약효를 감소시킬 수 있다(Devine et al., 1993; Johnson & Young 2002; Matzrafi et al., 2016; Strachan et al., 2010). 또한 토양 온도의 경우도 제초제의 분해에 영향을 주는 중요한 기후 요소 중 하나이다. 지온이 증가함에 따라 미생물 및 화학적 분해로 인한 제초제의 분해 속도가 향상되었다(Dong & Sun, 2016; Long et al., 2014). 따라서 상대적으로 높은 온도 조건하에서 제초제 약효가 감소될 수 있지만 반대로 상대적으로 온도가 낮은 조건하에서도 제초제 약효가 감소될 수 있다. 예를 들면 18°C와 32°C로 설정된 온실 조건하에 Abutilon theophrasti, Ipomoea hederacea, Xanthium strumarium, Amaranthus rudis, Digitaria sanguinalis를 대상으로 경엽처리제 mesotrione를 처리하여 약효를 비교하였을 때 Abutilon theophrasti, Ipomoea hederacea 및 Xanthium strumarium는 온도에 따른 약효차이는 없었지만, Amaranthus rudis 및 Digitaria sanguinalis는 32°C보다 18°C에서 GR50값이 각각 6배와 7배 더 높은 것으로 보아 아주 온도가 낮은 조건하에서 약효가 감소하는 것으로 나타났다(Johnson & Young, 2002). 또한 유사한 연구에서 29/17°C (주/야)보다 20/11°C (주/야)에서 돼지풀과 단풍잎돼지풀에 대한 2,4-D 및 glyphosate에 대한 약효가 감소되었다(Ganie et al., 2017).
깨풀에 경엽처리 제초제 glufosinate 및 mecoprop를 처리했을 때 처리 약량에 상관없이 이산화탄소 농도에 따른 약효는 차이가 없었다(Fig. 9). 그러나 glyphosate와 bentazone를 표준량과 1/2량 처리했을 때는 농도간에 약효차이는 없었으나, glyphosate의 경우는 1/4량 처리에서 400 ppm에 비해 800 ppm에서 약효가 낮았으나 bentazone의 경우는 오히려 400 ppm에 비해 800 ppm에서 높았다.

Fig. 9.
Control value (%) of Acalypha australis in response to foliar herbicides (A, Glyphosate-isopropylamine; B, Glufosinate-ammonium; C, Bentazone; D, Mecoprop) under 400 and 800 ppm CO2 in growth chambers (1/4 RR: 1/4 of the recommended rate; 1/2 RR: 1/2 of the recommended rate). Means within bars followed by the same letters are not significantly different at the 5% level according to Ducan’s Multiple Range Test.
깨풀에 토양처리 제초제 alachlor, metolachlor 및 linuron 처리의 경우 처리 약량에 관계없이 이산화탄소 농도간에 약효 차이는 없었다(Fig. 10). 그러나 ethalfluralin 표준량을 처리했을 때는 이산화탄소 농도간에 약효 차이가 없었으나, 1/4량과 1/2량을 처리했을 때 이산화탄소 농도가 400 ppm보다 800 ppm에서 약효가 더 높았다. 제초제 약효에 미치는 영향은 잡초의 종류, 이산화탄소의 농도, 처리 기간 등 다양한 요인에 의해 달라질 수 있다(Varanasi et al., 2015; Ziska et al., 2004). 한 예로 제초제 약효는 이산화탄소 농도가 증가하므로서 감소하였다(Ziska & Teasdale, 2000; Ziska et al., 2004). 또한 이산화탄소 농도가 증가하는 조건하에서 Canada thistle에 glyphosate을 처리하였을 때 약효는 감소하였다. 이산화탄소 증가는 식물의 형태 및 해부학적 변화를 유도하여 결과적으로 제초제의 흡수와 이행에 영향을 주어 약효를 감소하였다(Manea et al., 2011; Ziska & Teasdale, 2000).

Fig. 10.
Acalypha australis control value (%) in response to various soil herbicides (A, Alachlor; B, Metolachlor; C, Ethalfluralin; D, Linuron) under 400 and 800 ppm CO2 in the growth chamber (1/4 RR: 1/4 of the recommended rate; 1/2 RR: 1/2 of the recommended rate). Means within bars followed by the same letters are not significantly different at the 5% level according to Ducan’s Multiple Range Test.
온도 및 CO2 조건별 콩 약해 반응
콩에 선택성 토양처리 제초제를 표준량과 표준량의 2배를 콩에 처리했을 때 alachlor와 liuron의 경우는 온도증가에 따른 약해가 다소 증가하였으나, 온도간에 유의적인 차이가 없었다(Fig. 11). Metolachlor와 ethalfluralin의 경우도 약해가 경미할 뿐만 아니라 온도간에 유의적인 차이가 없었다.
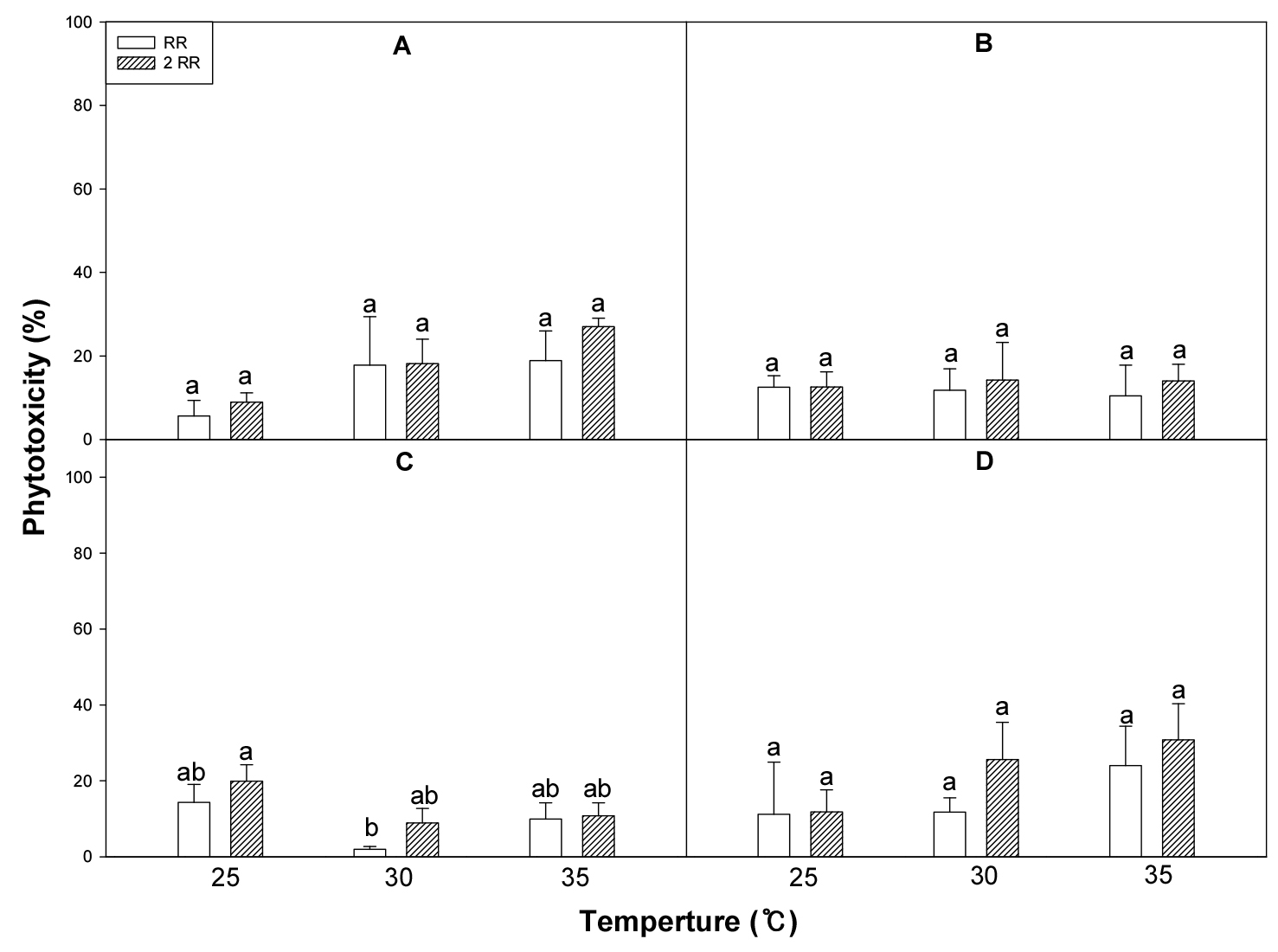
Fig. 11.
Soybean phytotoxicity (%) in response to various soil herbicides (A, Alachlor; B, Metolachlor; C, Ethalfluralin; D, Linuron) at different temperatures in the growth chamber (RR: recommended rate; 2 RR: 2 of the recommended rate). Means within bars followed by the same letters are not significantly different at the 5% level according to Ducan’s Multiple Range Test.
토양처리 제초제 alachlor, ethalfluralin 및 linuron을 표준량과 표준량을 2배 콩에 처리했을 때 이산화탄소 농도간에 약해는 유의적인 차이가 없었다(Fig. 12). Metolachlor를 표준량을 처리했을 경우에도 이산화탄소 농도가 높은 800 ppm 조건에서 400 ppm에 비해 유의적으로 적었으나 표준량 처리에서는 두 농도간에 유의적인 차이가 없었다. 전반적으로 4종의 토양제초제 종류에 상관없이 온도와 이산화탄소 농도 간에 콩의 약해는 20%로 경미한 수준이었다. 제초제의 약해는 다양한 요인에 의해 발생하며, 대표적인 약해 유발 요인으로 작물적 조건, 기상조건, 토양조건 등이 있다(Kudsk & Kristensen, 1992). Pline et al. (1999)의 연구에 따르면 경엽처리제인 glufosinate를 처리했을 때 낮은 온도에서 콩에 약해가 발생하였으나 일시적인 현상으로 회복되었다. 따라서 본 연구에서 사용된 토양처리제 제초제의 경우 온도와 이산화탄소 농도 변화에도 콩 포장에 안정적으로 사용할 수 있을 것으로 판단된다. 그러나 온도와 이산화탄소 농도는 깨풀의 생장과 일부 토양과 경엽처리 제초제 약효차이에 관여하는 것으로 보아 기후변화에 따른 새로운 잡초관리 방안과 대책을 마련해야 할 것으로 판단된다.

Fig. 12.
Soybean phytotoxicity (%) in response to various soil herbicides (A, Alachlor; B, Metolachlor; C, Ethalfluralin; D, Linuron) under 400 and 800 ppm CO2 in the growth chamber (RR: recommended rate; 2 RR: 2 of the recommended rate). Means within bars followed by the same letters are not significantly different at the 5% level according to Ducan’s Multiple Range Test.
적 요
본 연구의 목적은 기후변화에 따른 이산화탄소와 온도의 변화에 따른 콩밭 우점잡초 깨풀의 생장과 주요 4종의 경엽처리 제초제와 4종의 토양처리 제초제에 대한 약효와 콩의 약해를 평가하여 잡초 관리 방안을 마련하는 데 있다. 생장상과 온실상 조건하에서 온도가 증가할수록 깨풀의 초장 및 생체중은 증가하였다. 이산화탄소 농도에 따른 Fv/Fm, ETR, 초장, 엽면적 및 지상부 생체중은 400 ppm보다 800 ppm에서 더 높았다. 깨풀에 대한 경엽처리제 glufosinate 약효의 경우 생장상 조건의 20°C 및 25°C보다 30°C에서 온실상조건의 21°C 및 25°C보다 29°C에서 감소하였다. 반대로 mecoprop의 경우 생장상 조건의 30°C에 비해 20°C에서 온실상 조건의 29°C에 비해 21°C에서 약효가 감소하였다. 경엽처리제 glyphosate의 경우 온실상 조건하에서는 25°C와 29°C에 비해 21°C에서 약효가 감소하였다. Bentazone을 생장상 조건하에서 1/2량 처리하였을 때 25°C와 30°C에 비해 20°C에서 약효가 감소하였다. 그러나 온실상 조건하에서는 21°C와 25°C에 비해 29°C에서 약효가 감소하였다. 깨풀에 대한 토양처리제 경우 생장상과 온실상 조건하에서 metolachlor와 ethalfluraline의 약효는 온도가 상대적으로 높은 조건하에서 약효가 높았다. 그러나 linuron의 경우는 생장상과 온실상의 온도에 상관없이 약효차이가 없었다. Alachlor의 경우 온실상 조건하에서 19°C와 23°C에 비해 27°C에서 약효가 감소하였다. 경엽처리 제초제 4종을 표준량으로 깨풀에 처리하였을 때 이산화탄소농도에 따른 차이는 없었다. 그러나 깨풀에 glyphosate 1/4량 처리하였을 때 이산화탄소 농도가 400 ppm보다 800 ppm일 때 약효는 감소하였다. 반대로 bentazone를 1/4량 처리하였을 때 이산화탄소 농도가 400 ppm보다 800 ppm일 때 약효는 증가하였다. Glufosinate은 처리약량에 상관없이 이산화탄소 농도에 따른 유의적인 차이가 없었다. 토양처리 제초제 ethalfluralin을 1/4량 처리하였을 때는 이산화탄소의 농도가 800 ppm일 때 약효가 더 높았다. 그 외의 제초제의 경우 이산화탄소 농도와 상관없이 깨풀의 약효에는 차이가 없었다. 콩에 토양처리 제초제를 표준량과 표준량의 2배량을 처리하였을 때 온도와 이산화탄소 농도에 따른 약해는 유의적인 차이가 없었다. 따라서 온도와 이산화탄소 농도 증가에 기인하여 일부 제초제에 대한 잡초 약효 차이가 있어 기후변화에 의한 새로운 잡초 관리 방법을 개발해야 할 것으로 판단된다.






