서론
재료 및 방법
콩 발아실험
열처리
이소플라본 함량 분석
통계분석
결과 및 고찰
Acetyl 및 malonylglucosides 확인
콩 발아와 이소플라본 함량
식물생장조절제와 쿠마르산이 이소플라본 함량에 미치는 영향
열처리 콩의 이소플라본 함량
적 요
서론
콩은 영양성분이 우수할 뿐만 아니라 여러 가지 생리활성물질을 갖고 있어 동양뿐만 아니라 서양에서도 건강식품으로서의 가치가 높다. 특히 콩에 함유되어 있는 이소플라본은 항산화(Rodriguez-Roque et al., 2013; Dhayakaran et al.., 2015) 및 항암효과(Wu et al.., 1998; Nielsen & Williamson, 2007; Messina, 2014) 등 여러 기능이 있는 것으로 밝혀짐에 따라 최근까지도 많은 연구가 이루어지고 있다(Ko et al.., 2017).
따라서 콩의 이소플라본 함량을 높이기 위한 노력도 계속되고 있는데, 이소플라본 함량은 유전적 요인(Wang & Murpy, 1994)에 의해 영향을 받지만 환경적 영향도 매우 크다(Tsukamoto et al.., 1995; Kim et al.., 1996; Kim & Kim, 1997). 콩 재배 시 등숙기의 온도가 이소플라본 함량에 영향을 미치며(Tsukamoto et al.., 1995; Lee et al.., 2008), 등숙기에 수분공급이 제한되면 그 함량이 떨어진다는 연구결과도 발표된 바 있다(Gutierrez-Gonzalez et al.., 2010). 또한 최근에는 이소플라본 축적과 관련된 유전자가 속속 밝혀지고 있으며(Yoneyama et al.., 2016), 이에 관련된 연구도 많이 수행되고 있다. Yuk et al.. (2016)은 R3 시기의 콩잎에 에틸렌을 처리함으로써 이소플라본 함량을 높일 수 있다고 하였으며, 에틸렌 처리 시 잎에 있는-페닐알라닌에서 이소플라본으로 진행되는 생합성과정에 관여하는-CHS, CHI, IFS, HID, IF7GT 및 IF7MaT 등의 유전자 발현이 커진다고 하였다. 한편, 콩에서 종자 발아 시 이소플라본 함량이 증가된다는 연구결과도 있다(Chung, 1998; Kim et al.., 1999).
이소플라본은 총 12종으로 구분되는데 지금까지 콩에서의 연구는 대부분 aglycone 형태인 genistein, daidzein 및 glycitein에 집중되어 왔다. Hutchins et al.. (1995)은 콩 이소플라본은 발효과정에서 배당체가 가수분해되어 aglycone 형태로 존재하는 경우가 많다고 하였으며, Kim et al.. (1999)은 콩의 발효식품에서는 이소플라본이 aglycone 형태이지만 비발효 식품에서는 배당체로 존재하며, 콩의 배아에 이소플라본이 많이 집적되어 있다고 하였다. 그동안 aglycone 중 특히 genistein의 생리활성 효과(Coward et al.., 1993; Record et al.., 1995; Ko et al.., 2017)에 대한 연구결과가 많이 발표되었으며, Yu et al.. (2016)은 이소플라본 배당체는 체내 소장에서 glucosidase에 의해 aglycone으로 가수분해되며, genistein이 daidzein보다 생리활성이 높다고 하였다. 한편, 소화 후 혈장에서 이소플라본은 약 24시간 존재하며, 평균적인 반감기는 6~8시간이라는 연구결과가 발표된 바 있다(Manach et al.., 2005).
최근에 Ahmad et al.. (2017)은 malonylglucosides가 콩에 함유된 이소플라본 중 주된 이소플라본이라고 하였다. 그동안 aglycone과 glucosides에 비해 acetylglucosides 및 malonylglucosides에 대한 연구는 미흡하였는데, glucosides는 쉽게 aglycone으로 전환되어 버리므로 acetylglucosides와 malonylglucosides의 확인이 어려웠던 것이 하나의 원인이라 사료된다. 이소플라본 중 malonylglucosides 확인은 주로 red clover에서 분석되었는데(Edwards et al.., 1997; Wu et al.., 2003; Lin et al.., 2000; Toebes et al.., 2005), 추출용매 및 방법에 따라 red clover 시료에서 malonylglucosides가 확인되는 정도가 달랐다. Ahmad et al.. (2017)은 유전자 GmlMaTs가 malonylglucosides 합성에 관여한다고 하였으며, 또한 여러 가지 스트레스에서 이소플라본 함량을 분석한 결과 스트레스 종류에 따라 조직 및 기관에서 나타나는 이소플라본 함량에 차이가 있으며 유전자의 발현도 다르다고 하였다. 한편, Li et al.. (2016)은 형질전환체를 이용하여 이소플라본 합성 생합성과정에 관여하는 유전자를 탐색한 바 있다.
본 연구에서는 콩 발아기간 동안 생장조절제 및 쿠마르산 처리를 통하여 이소플라본 함량이 증가되었으며, 특히 malonylglucosides를 비롯한 여러 배당체들의 존재를 확인할 수 있었기에 이를 보고하고자 한다.
재료 및 방법
콩 발아실험
공시재료는 2016년 국립식량과학원에서 재배된 대풍2호, 우람콩(Ko et al.., 2016), 풍산나물콩(Suh et al.., 1997) 등 3품종을 분양받아 사용하였다. 발아실험은 28°C 생육상에서 수행하였으며 페트리디시에 100립씩 치상된 콩을 완전임의로 3반복으로 배치하고 하루에 4번 간격으로 충분하게 수분을 공급하였다. 치상된 콩 종자는 발아 1일, 3일, 5일째에 각각 회수하였으며, 부패 등으로 발아가 정상적으로 이루어지지 않은 종자를 제외한 모든 발아종자를 반복 및 처리구별로 혼합하여 이소플라본 분석에 사용하였다. 단, 5일차 시료는 종자의 형태가 아니라 발아기간을 통하여 어느 정도 생육이 진전된 관계로 자엽과 배축을 따로 분리하여 이소플라본 함량을 분석하였다. 한편, 생장조절제 등이 콩 발아기간 동안 이소플라본 함량 증대에 미치는 영향을 확인하고자 식물생장조절제인 지베렐린(GA), NAA 및 BA와 이소플라본 생합성 과정 중 전구물질 중의 하나인 쿠마르산을 구입하여 콩 발아실험에 적용시켰다. 발아기간 동안 수분공급 시 증류수에 지베렐린 2%, NAA 4%, BA 4%, 그리고 쿠마르산 2.5%를 각각 용해시킨 후 발아실험에 사용하였다.
열처리
열처리가 이소플라본 함량에 미치는 영향을 알아보았다. 공시품종의 종자를 60°C에서 1시간 열처리하고 흐르는 수돗물에서 냉각시킨 후 이소플라본 함량을 분석하였다.
이소플라본 함량 분석
발아실험이 완료된 시료는 동결건조시키고 마쇄기로 100 mesh로 분쇄한 후 HPLC (Waters Alliance 2695 system, Waters Corp., USA)를 사용하여 이소플라본 함량을 분석하였으며, Toebes et al.. (2005)의 방법을 응용하여 수행하였다. HPLC 분석을 위한 전처리 방법은 먼저 시료 100 mg을 MeOH 2 ml로 vortexing한 후 20분간 sonication시켰다. 이후 시료액 500 ul과 아세톤 500 ul를 혼합한 후 45분간 -22°C에서 방치시켰으며, 다시 시료 혼합액을 10,000 rpm에서 2분간 원심분리하였다. 원심분리된 상층액은 0.45 um PVDF로 filtering한 후 이소플라본 함량 분석에 사용되었다. HPLC 분석에는 C18 칼럼(2.7 um, 4.6 x 150 mm)과 UV detector의 270 nm 파장을 사용하였다. 용매는 0.1% formic acid와 acetonitrile을 혼합하여 조합별로 gradient에 따라 1.0 mL/min 속도로 흘려주었다. 이소플라본 표준물질은 12종은 모두 시중에서 구입-daidzein, glycitein, genistein, daidzin, glycitin 및 genistin은 Extrasynthese사(HPLC ≥95%, France), 6’-O-malonyldaidzin, 6’-O-malonylgenistin, 6’-O-malonylglycitin, 6’-O-acetyldaidzin, 6’-O-acetylgenistin 및, 6’-O-acetylglycitin은 Wako사(90%, Japan)-후 사용하였다.
통계분석
모든 실험은 3반복으로 수행되었으며, 실험결과는 SPSS (Version 17.0, SPSS Institute Inc., Chicago, IL, USA)를 사용하여 통계처리하였다.
결과 및 고찰
Acetyl 및 malonylglucosides 확인
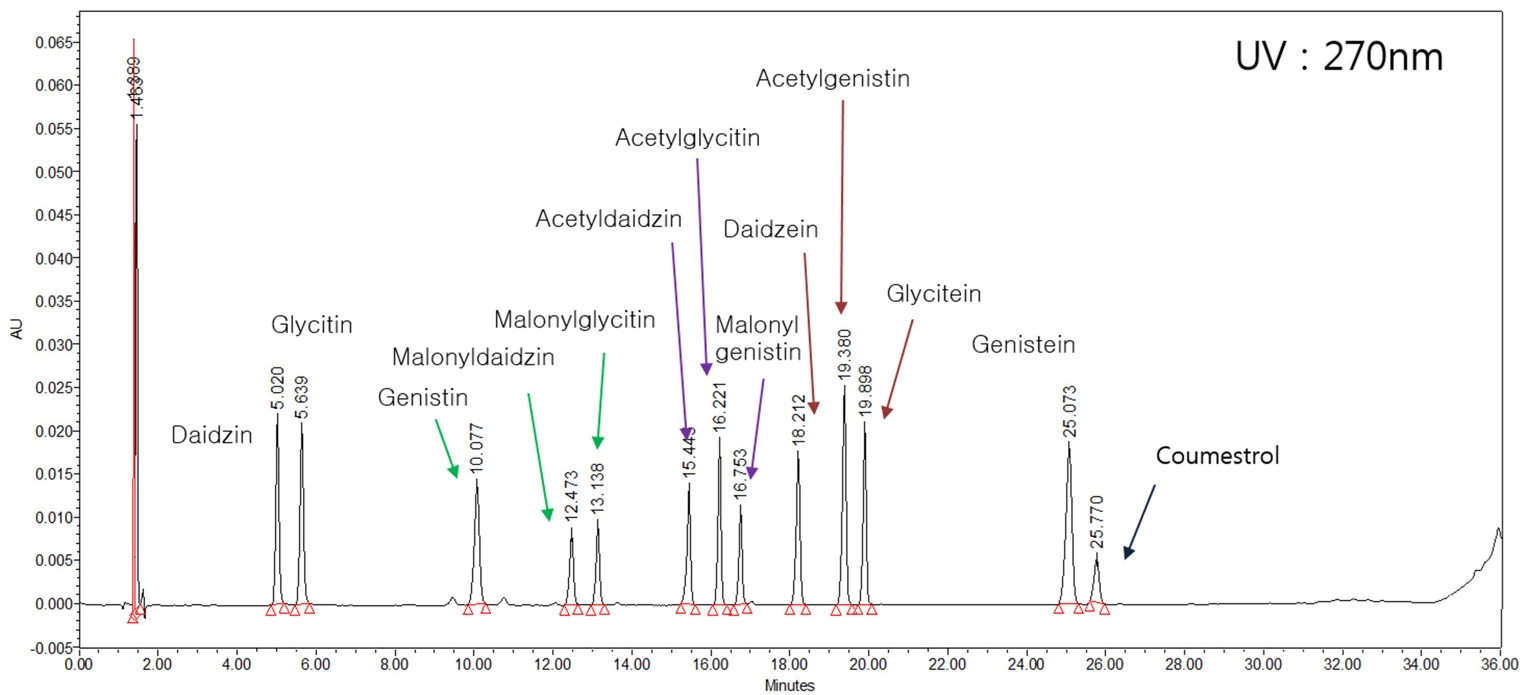
이소플라본은 aglycone인 daidzein, glycitein, genistein 등 3종과 이들의 glucosides 형태인 daidzin, glycitin, genistin 등 3종, 그리고 malonylglucosides 3종(6’-O-malonyldaidzin, 6’-O-malonylgenistin, 6’-O-malonylglycitin) 및 acetylglucosides 3종(6’-O-acetyldaidzin, 6’-O-acetylgenistin, 6’-O-acetylglycitin)등 총 12종이 알려져 있다.
Fig. 1은 본 연구에서 사용된 이소플라본 표준물질 12종의 HPLC chromatogram을 나타낸 것이다. 한 번의 HPLC 분석으로 12종 모든 성분의 확인이 가능하였으며, 각 성분별 검량식의 기울기는 모두 0.99 이상을 나타내어 표준물질의 분석방법에는 이상이 없음을 판단할 수 있었다. 한편, 본 연구에 사용된 이소플라본 함량분석법은 HPLC를 사용하여 red clover에서 이소플라본의 배당체를 확인한 Toebes et al.. (2005)의 방법을 응용하여 수행하였다.
이소플라본 조성에 관한 실험은 Franke et al.. (1994)이 red clover sprouts를 96% 에타놀과 10M HCl에서 추출하여 이소플라본 분석을 한 결과 모두 aglycone만 분석되었다고 한 반면, Edwards et al.. (1997)은 red clover 유묘를 아세톤과 메타놀을 사용하여 분석한 결과, 이소플라본 조성이 malonylglucosides 95% 및 aglycone 5%로 나타났다고 하였다. He et al.. (1996)은 red clover를 에타놀 7 : 메타놀 3으로 추출한 결과 glucosides 69%와 aglycone 31%를 얻었다고 하였으며, 이외에도 다른 여러 추출 용매를 사용함으로써 aglycone, glucosides, malonylglucosides의 조성비가 다르게 분석되었다는 연구결과들이 있다(Lin et al.., 2000; Wu et al.., 2003). 본 연구에서는 메타놀과 아세톤을 용매로 사용함으로써 그동안 콩에서 쉽게 확인이 어려웠던 acetylglucosides와 malonylglucosides를 분석할 수 있었다.
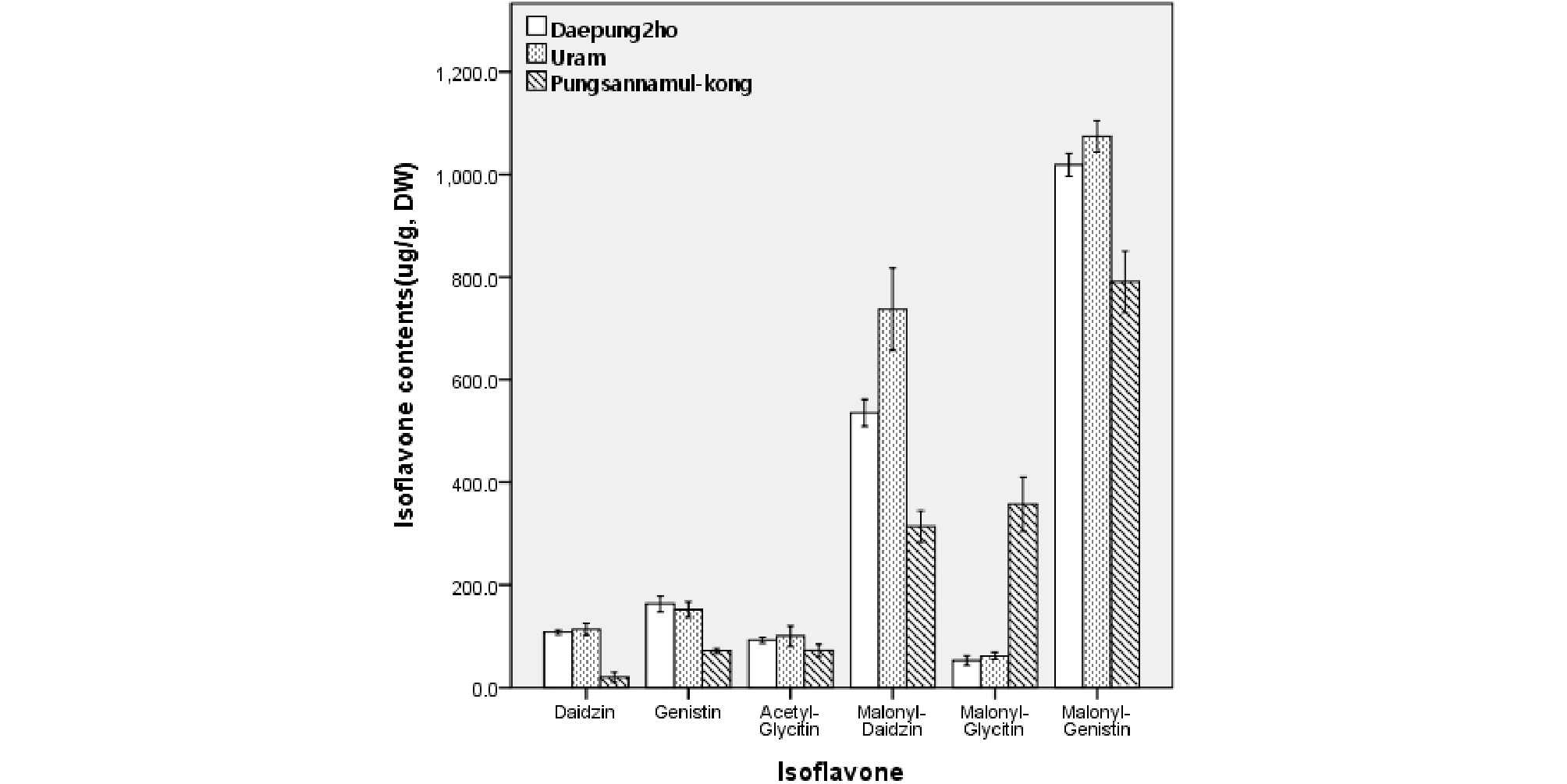
Fig. 2는 대풍2호, 우람콩 및 풍산나물콩 종자에 함유된 이소플라본 함량을 분석한 결과이다. HPLC 분석 결과 aglycone이 아닌 배당체만이 분석되었으며, 특히 malonylglucosides 함량이 총 이소플라본 함량의 81.5~90.0%로 나타났다. 이는 Ahmad et al.. (2017)이 malonylglucosides가 콩에 함유된 이소플라본 중 주된 이소플라본이라고 한 것과 일치하였다. 작용기가 붙지 않은 순수 배당체로는 daidzin과 genistin이 분석된 반면 glycitin은 분석되지 않았다. Aglycone만 분석된 기존의 연구(Kim & Kim, 1997; Kim et al.., 1999)에서도 glycitein 은 타성분에 비해 함량이 상당히 적었던 것으로 보아 콩에는 glycitein을 포함한 그 배당체들의 함량이 적다고 판단할 수 있었다. Malonylglucosides에서도 malonylgenistin과 malonyldaidzin에 비해 malonylglycitin의 함량은 적게 나타났다. 그러나 Fig. 2에서 보는 바와 같이 daidzin과 genistin의 acetyl 형태는 분석되지 않은 반면 acetylglycitin은 그 함량이 분석되어진 것이 의외라 하겠다. 품종 간 전체 이소플라본 함량은 우람 > 대풍2호 > 풍산나물콩의 순으로 높게 나타났다.
콩 발아와 이소플라본 함량
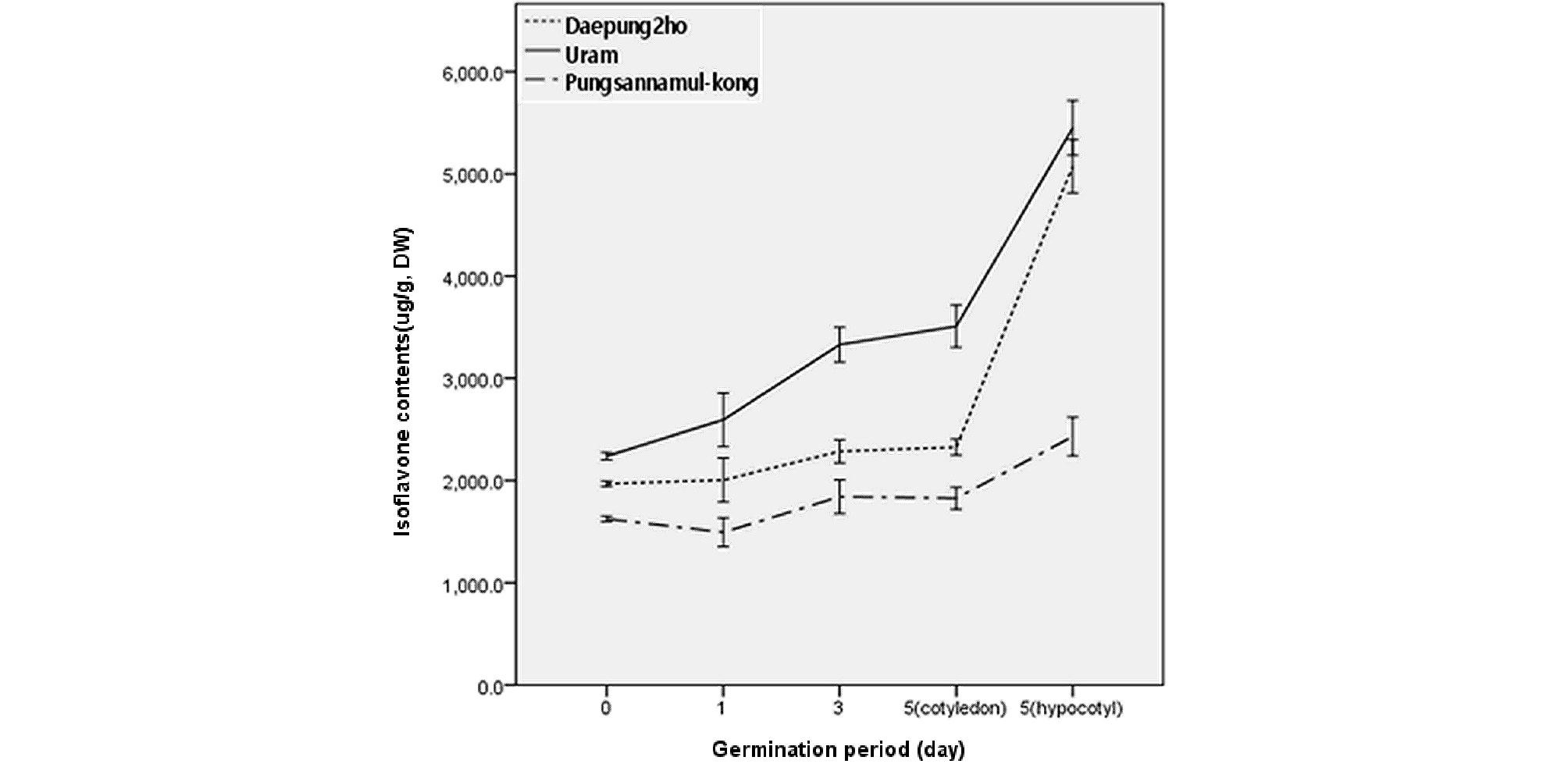
Fig. 3은 1일, 3일, 5일 등 발아시간 경과별로 시료를 회수하여 총 이소플라본 함량을 분석한 결과이다. 1일 및 3일차 시료는 발아된 상태 그대로 분석한 반면 5일차 시료는 자엽과 배축을 분리하여 따로 분석하였다.
그림에서 보는 바와 같이 콩에 함유된 이소플라본은 Fig. 2와 대비하여 볼 때 발아시간이 경과함에 따라 함량이 증가하였다. 5일차 자엽에서의 이소플라본 함량이 3일째 시료의 함량과 비슷하며 5일차 배축에서의 이소플라본 함량이 높게 분석된 것으로 보아 발아 5일차에도 이소플라본 함량은 계속 높아진다고 판단할 수 있었다. Chung (1998)은 콩 발아 6일차 까지 이소플라본 함량이 높아진다고 하였다. 그러나 발아시간이 지속되더라도 계속 자엽에서 이소플라본 함량이 증가될 것으로는 생각되지 않는다. 앞에서 언급하였다시피 공시된 3품종 모두 5일차 자엽에서의 함량과 3일차 발아종자에서의 함량이 비슷하였다는 것이 이를 판단하는 근거가 될 수 있으리라 사료된다. 한편, Kim et al.. (2004)과 Jeon et al.. (2005)은 콩의 이소플라본 함량이 발아 중반까지는 높아졌다가 다시 감소한다고 보고한 바 있어 본 연구의 실험결과와는 다소 차이가 있었다.
공시품종 간 발아기간 경과에 따른 이소플라본의 함량은 발아 전의 종자와 마찬가지로 우람 > 대풍2호 > 풍산나물콩의 순으로 이소플라본 함량이 높았다. 그런데 그림에서 보는 바와 같이 발아시간 경과에 따라 대풍2호와 우람콩에서 이소플라본 함량이 증가 하는 정도가 풍산나물콩에서 보다 크게 나타났다. 따라서 이소플라본 함량은 유전적인 요인에 영향을 받는다는 것을 간접적으로 판단할 수 있었다. 그리고 총 이소플라본 함량이 높아짐에 따라 이소플라본 종류에 따라 특이하게 함량이 증가되는 성분은 없었으며, 이소플라본 종류별 함량은 종자에서의 비율과 대동소이하였다. 그러나 종자에서는 확인되지 않았던 aglycone 성분이 발아된 시료에서는 일부 분석되어짐을 확인할 수 있었다.
식물생장조절제와 쿠마르산이 이소플라본 함량에 미치는 영향
공시품종 3품종을 사용하여 식물생장조절제와 쿠마르산 첨가가 콩 발아 중 이소플라본 함량에 미치는 영향을 알아보았다(Table 1). 식물생장조절제는 GA, BA 및 NAA를 사용하였다. 쿠마르산은 이소플라본 생합성 과정의 중간물질 중 하나이다.
Table 1. Total isoflavone content of soybean seeds during different germination treatments (ug/g, DW).
*The same letter in a row is not significantly different to DMRT (5%).
콩 발아기간 중 biotic 물질 처리는 수분만 공급하는 일반 발아과정과 마찬가지로 발아시간이 경과함에 따라 이소플라본 함량이 증가하였으며, 이소플라본은 배축에 상당량이 축적됨을 확인할 수 있었다. 일반 발아과정과 비교할 때 생장조절제와 쿠마르산 처리는 5일째 자엽을 제외하고는 이소플라본 함량에서 유의성이 나타나 대체로 이소플라본 함량을 높이는 효과가 있는 것으로 판단된다. 이는 발아 1일에서 3일로 진행되면서 더 높아지는 경향이었으며, 특히 NAA 처리 3일차 시료는 이소플라본 함량이 2,784.5 ug/g을 나타내어 일반 수분공급의 1,963.4 ug/g보다 훨씬 높았다. 한편, 배축에서의 이소플라본 함량은 처리 간에 유의성이 나타났는데 쿠마르산을 처리한 시료가 8,568.7 ug/g을 보여 생장조절제 처리에 비해 훨씬 높았다. 그런데 배축에서는 발아 1일차, 3일차 시료 및 자엽에서 나타난 경향과 달리 지베렐린과 BA 처리가 일반 수분공급처리보다 유의성은 없었으나 이소플라본 함량이 적은 것으로 분석되었다. 그렇지만 지베렐린과 BA가 처리된 자엽과 배축의 이소플라본 함량을 합으로 한 5일차 총량에서는 원료 콩보다 높아진 것이 확실하다. 따라서 발아과정 중 배축에 미치는 생장조절제의 영향은 추후 다방면에서 깊은 검토가 필요한 것으로 사료된다.
Table 2는 공시품종별로 생장조절제 및 쿠마르산이 이소플라본 함량에 미치는 영향을 분석한 결과이다. 대풍2호는 발아시간이 경과함에 따라 이소플라본 함량이 높아졌다. 발아 1일차에서는 처리 간 유의성은 없었으나 생장조절제와 쿠마르산 처리가 수분공급보다 이소플라본 함량이 높았다. 발아 3일차와 자엽에서는 처리 간 유의성이 인정되었으나 처리 간 특이한 경향은 나타나지 않았는데, 3일차에서는 BA와 NAA의 효과가 가장 컸던 반면 자엽에서는 쿠마르산의 효과가 크게 나타났다. 우람에서도 발아시간 경과에 따라 이소플라본 함량이 높아졌으며, 발아 1일, 3일 및 자엽 모두에서 처리 간 유의성이 인정되었다. 1일차에서는 BA와 쿠마르산이, 3일차에서는 BA와 NAA의 효과가 컸다. 그런데 자엽에서는 쿠마르산 처리가 수분처리를 포함한 기타 생장조절제 처리보다 이소플라본 함량이 떨어졌다. 이는 Fig. 4에서 나타난 바와 같이 발아 5일차 우람의 경우 배축에서 이소플라본 함량이 높아진 것이 자엽에서의 함량을 떨어뜨린 것이 아닌가 사료된다. 앞으로 콩나물 발육뿐만 아니라 관련 유전자 발현 등을 통해 검증할 필요가 있을 것이다. 풍산나물콩 역시 이소플라본 함량은 발아시간이 경과함에 따라 높아지며 처리 간 유의성이 인정되었다. 그러나 전반적으로 대풍2호나 우람에 비해 이소플라본 함량 증가의 폭이 적었다. 그리고 NAA 처리의 경우 발아 3일차 시료가 1일차 보다 이소플라본 함량이 적었다. 이는 품종의 특성이 반영된 결과일 것으로 사료되나 추후 많은 유전자원을 대상으로 검증이 이루어져야 할 것이다.
Table 2. Total isoflavone content of soybean seeds different germination treatments, arranged by cultivar (ug/g, DW).
*The same letter in a row is not significantly different to DMRT (5%).
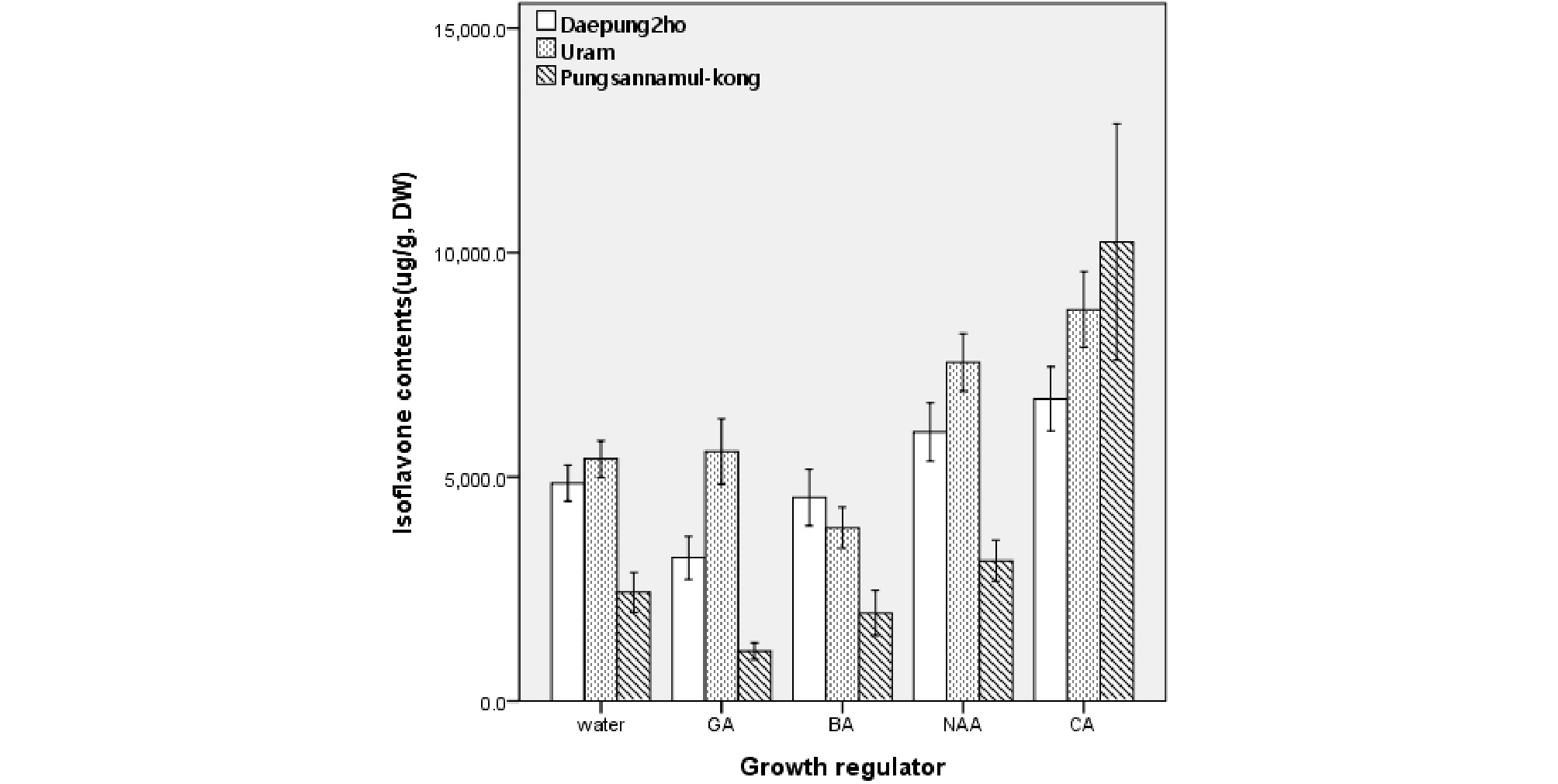
Fig. 4는 발아 5일차 배축에서의 생장조절제 및 쿠마르산 처리에 따른 이소플라본 함량을 분석한 결과이다. 대풍2호와 우람의 경우 NAA와 쿠마르산, 풍산나물콩의 경우 쿠마르산의 효과가 크게 나타났다. 특히 풍산나물콩의 경우 지베렐린과 BA 처리가 일반적인 수분공급에 비해 오히려 배축에서 이소플라본 함량이 떨어졌으나 쿠마르산을 처리한 경우에는 10,240 ug/g의 함량을 나타내어 다른 품종 및 생장조절제 처리에 비해 월등히 높았다. 한편, 쿠마르산 처리는 대풍2호와 우람의 배축에서도 이소플라본 함량이 높게 분석되었으므로 앞으로 이를 콩나물 재배에 적용시킬 경우 생리활성의 제고 등 이점이 크게 부각될 수 있으리라 판단된다.
생장조절제와 쿠마르산이 처리된 발아 후 3일차 시료를 대상으로 이소플라본 종류별 함량을 분석하였다(Table 3). 품종간 이소플라본 함량은 우람 > 대풍2호 > 풍산나물콩의 순서로 나타나 발아 전 원료 콩의 경향과 같았다. 대풍2호에서 처리 간 이소플라본 총 함량은 유의성이 없었으나 NAA 처리에서 가장 높고 지베렐린 처리에서 가장 낮았다. 이소플라본 종류별로는 malonylglucosides가 전체의 83.7~ 86.6%를 차지하여 가장 높았으며, 그 다음으로는 glucosides, acetylglucosides 순이었고 aglycone은 분석되지 않았다. 우람에서도 처리 간 총 함량에서 유의성은 없었으나 NAA와 BA 처리에서 높았고 쿠마르산 처리에서 가장 낮게 분석되었다. 이소플라본 종류에서는 처리 간 유의성이 나타났는데, malonylglucosides의 경우 쿠마르산 처리가 다른 처리에 비해 이소플라본 함량이 적었으며 glucosides 경우는 BA 처리가 유의성 있게 높은 반면 지베렐린과 쿠마르산 처리에서는 낮게 나타났다. 이소플라본 종류별 비율은 malonylglucosides가 전체의 80.9~87.2%로 나타나 변이 폭이 대풍2호 보다 넓었으며 역시 aglycone은 분석되지 않았다. 풍산나물콩에서의 총 함량은 처리 간 유의성이 있었으며 쿠마르산 처리에서 높고 BA 처리에서 낮았다. 이소플라본 종류에서도 모두 처리 간 유의성이 인정되었다. Acetylglucosides 및 malonylglucosides에서는 쿠마르산 처리가 제일 함량이 높았으며, glucosides의 경우 BA 처리에서 함량이 낮았다. 이소플라본 종류별 비율은 대풍2호 및 우람콩과 같은 경향이었으며, malonylglucosides는 전체 함량의 86.7~90.4%를 차지하여 공시된 3품종 중에서 그 비율이 가장 높았다.
Table 3. Isoflavone content in soybean seeds after a 3-day germination period with different treatments, arranged by cultivars and isoflavone groups (ug/g, DW).
*The same letter in a row is not significantly different to DMRT (5%).
최근에는 prenylated isoflavonoid의 생리활성 가능성이 제기되는 등(Yoneyama et al.., 2016) 이소플라본류에 대해 세밀한 연구들이 진행되고 있다. Malonylglucosides는 분석의 어려움 등으로 인하여 그동안 연구가 미흡하였지만 Ahmad et al.. (2017)이 malonylglucosides가 콩의 주된 이소플라본이라고 보고한 바 있으며, 본 연구의 실험결과도 이를 뒷받침하고 있다. 따라서 앞으로는 malonylglucosides에 대한 새로운 접근방식이 많이 시도되어야 할 것으로 생각된다.
열처리 콩의 이소플라본 함량
60°C에서 1시간 열처리 한 콩을 대상으로 발아실험을 수행하고 발아일수 경과별로 이소플라본 함량을 분석하였다. 공시품종의 원료 콩과 열처리 콩 종자의 이소플라본 함량을 분석한 결과 대풍2호와 우람은 열처리에 의해 이소플라본 함량이 높아졌으나 풍산나물콩은 오히려 함량이 줄어들었다(Table 4). 콩의 이소플라본 함량은 환경적 요인에 영향을 크게 받을 뿐만 아니라(Kim & Kim, 1997; Gutierrez-Gonzalez et al.., 2010), 각종 스트레스에서도 영향이 있는 것으로 보고된 바 있다(Ahmad et al.., 2017). 따라서 열처리도 품종에 따라 이소플라본 함량을 높이는 효과가 있는 것으로 사료되나 추후 다양한 유전자원으로 좀 더 검토되어야 할 것이다. 풍산나물콩은 열처리로 인해 이소플라본 함량이 50% 이상 줄었지만 온도 변화 등 다양한 열처리 방법을 통해 재검토가 필요할 것으로 사료된다. 한편, 열처리된 콩의 이소플라본 조성도 열처리되지 않은 기타 시료와 같이 malonylglucosides가 전체의 80% 이상을 차지하였다.
Table 4. Total isoflavone content in soybean seeds with heat treatment, arranged by cultivar (ug/g, DW).
| Daepung2ho | Uram | Pungsannamul-kong | Mean | |
| Fresh seed (A) | 1969.4±25.5 | 2238.6±36.5 | 1625.1±266.5 | 1944.4±305.5 |
| Heated seed (B) | 2131.9±107.5 | 3047.9±101.2 | 731.5±54.6 | 1970.4±187.3 |
| p-value* | 0.025 | 0.016 | 0.001 | - |
*t-Test p-value: between the fresh seed and the heated seed
적 요
콩 발아기간 동안 이소플라본 함량 증가를 위하여 생장조절제(GA, NAA, BA) 및 쿠마르산 처리를 하였다. 공시재료는 2016년에 재배된 대풍2호, 우람콩, 풍산나물콩 등 3 품종을 사용하였다.
공시품종의 이소플라본 함량을 분석한 결과 우람 > 대풍2호 > 풍산나물콩의 순으로 이소플라본 함량이 높았다. 이소플라본 종류별로는 malonylglucosides가 81.5~90.0%로 나타나 콩 이소플라본의 주된 성분임을 알 수 있었으며, 다음으로는 glucosides, acetylglucosides 순이었고 aglycone은 분석되지 않았다. 배당체로는 daidzin과 genistin이 분석된 반면 glycitin은 분석되지 않았고 acetylglucosides에서는 acetylglycitin만 분석되었다.
발아시간이 경과함에 따라 이소플라본 함량은 증가하였으며 식물생장조절제와 쿠마르산을 첨가한 경우도 마찬가지였다. 그런데 생장조절제와 쿠마르산 처리는 단순한 수분공급 처리와 비교할 때 총 이소플라본 함량에서 처리 간 유의성은 없었으나 대체로 이소플라본 함량이 높게 분석되어졌다. 발아 5일차 배축에 이소플라본이 상당량 축적됨을 확인할 수 있었으며, 풍산나물콩의 경우 쿠마르산 처리 시 10,240 ug/g의 함량을 보여 다른 품종 및 처리에 비해 월등히 높았다. 발아 3일차 시료에서 이소플라본 종류별 함량을 분석한 결과 발아에 사용된 원료 콩 종자에서와 같이 malonylglucosides가 전체의 83.7~86.6%를 차지하여 가장 높았다.
또한 60°C에서 1시간 열처리한 콩이 열처리하지 않은 콩 보다 이소플라본 함량이 높아짐을 확인하였으며, 따라서 다양한 스트레스를 통하여 이소플라본 함량을 높일 수 있을 것으로 사료된다.