서 론
재료 및 방법
수분 조건 및 과산화수소 처리 방법
수수 생육 및 수량 관련 형질 조사
생리적 형질 조사
단백질 발현 변화
통계 분석
결과 및 고찰
수수 생육 및 수량 관련 형질 조사
생리적 형질 조사
단백질 발현 변화
적 요
서 론
수수(Sorghum bicolor L. Moench)는 식물학적으로 화본과(Poaceae)에 속하는 일년생식물로(Kim et al., 2006) 열대 아프리카에서 유래되었으며, 열대 및 아열대 기후 지역에서 많이 재배되고 있다. 수수가 열대 기후에 잘 적응하는 이유는 줄기와 잎의 표면에 얇은 왁스층이 발달했고, 중륵을 따라 기동세포가 발달되어 있어 건조 시에는 급속히 잎을 접어 증산을 억제할 수 있기 때문이다(Chang et al., 2005). 특히 최근 들어 지구온난화가 급속하게 진행되면서 극심한 가뭄과 사막화 등의 문제점이 커지고 있어(Fraedrich et al., 2001; Beck et al., 2006), 이상 기후에 대비하여 수수와 같은 가뭄에 강한 작물 연구가 시급한 실정이다.
봄에 수수를 파종하는 우리나라의 경우 봄철 가뭄 발생은 수수의 초기 생육 및 발근에 부정적인 영향을 주게 되고, 지속적인 한발 조건에서는 관수를 시행하더라도 광합성 능력이 정상화되기까지 수일이 소요되므로 수수의 수량에서도 영향을 준다(Souza et al., 2004). 한발은 기본적으로 토양 수분 부족에 기인하므로 근본적인 대책은 관수를 하는 것이며, 관수가 곤란할 경우는 재배적 조치로 토양 피복, 중경 외에도 육종학적 방법으로 내한성 품종 개발 등이 있으나, 이러한 방법들은 노동력과 시간 및 경제적 비용이 소요되는 단점 및 한계가 있다.
한발 피해에 대한 작물의 내성 강화는 근권 발달 강화, 증산 억제를 통한 체내 수분 함량 유지와 같은 수분관계의 조절이 대표적인 방법이다. 수분 스트레스로 인한 또다른 피해는 산화적스트레스에 의한 것이며 이러한 피해는 항산화능력 강화로 그 피해를 줄일 수 있다(Liu et al., 2010; Yushi et al., 2011). 이와 관련하여 항산화 능력의 증진을 위한 방법으로 과산화수소의 인위적 처리가 효과를 나타낸다고 알려져 있으며, 여러 작물들에서 그 효과가 보고되었다(Byun & Choi, 2003; Woo et al., 2006; Woo et al., 2005).
본 연구는 기후 변화로 야기되는 한발 스트레스에 대한 대처 방안으로 과산화수소 처리가 수수의 생육 및 수량 관련 형질에 미치는 효과를 분석하였다. 또한 향후 수수의 내한성 증진을 위한 품종 육성과 재배법 개선의 기초 자료로 활용하고자 한발 조건 하에서 과산화수소 처리에 의한 수수 잎의 단백질 변화 특성을 확인하였다.
재료 및 방법
수분 조건 및 과산화수소 처리 방법
공시재료로 2004년 국립식량과학원에서 육성된 조숙성 및 다수성 품종인 황금찰수수를 이용하였다. 자연 강우를 배제하기 위해 비가림 시설(5 m×30 m)에서 15 cm 간격으로 점적공이 뚫린 점적 호수를 설치하여 적습 및 한발 수준을 조절하였다. 수수는 2016년 6월 17일에 육묘 트레이에 파종한 뒤, 주간·조간 거리는 30×100 cm로 하여 비가림 시설에 7월 1일 이식하였다. 이식 1일 전 수수 유묘에 무처리는 증류수(0 mM)로, 과산화수소 처리는 10 mM 농도로 각각 엽면 처리하였다. 적습 조건은 2일 간격(이식 당일 포함)으로 2시간씩 점적 구당 625 ml·h-1을 관수하여 모관수 pF 2.86~2.91 (≒-0.8~-1.0 MPa) 수준으로 토양 수분을 조절하였으며, 한발 조건은 10일 간격(이식 당일 포함)으로 1시간씩 점적 구당 625 ml·h-1을 관수하여, 토양 수분 상태를 pF 4.53~4.56 (≒-3.1~-3.5 MPa) 수준으로 토양 수분을 조절하였다.
수수 생육 및 수량 관련 형질 조사
생육 조사
생육 조사는 이식 30일과 60일때 수수의 초장 및 줄기 직경, 엽장 및 엽폭을 측정하였다. 그에 따른 방법으로 초장은 지면에서부터 이삭끝까지 길이를 측정하였고, 줄기 직경은 줄기 첫째 마디와 둘째 마디 사이의 두께, 엽장과 엽폭은 상위 3번째 엽의 길이와 폭을 측정하였다.
수량 관련 형질 조사
수량 조사는 건물중, 수분 함량, 이삭 길이, 주당 이삭중, 주당 종실중, 천립중을 10반복으로 조사하였다. 식물체 수분 함량은 생체중 및 건물중 차이를 이용하여 구하였으며, 이삭중과 종실중은 재식밀도를 고려하여 ha 당 이삭중 및 종실중으로 표기하였다.
생리적 형질 조사
엽 녹색도(SPAD), 엽록소 형광(Fv/Fm)
생리적 형질 조사는 이식 30일 차에 상위 3번째 잎의 중간 부분을 대상으로 엽 녹색도(SPAD)와 엽록소 형광(Fv/Fm)으을 조사하였다. 엽 녹색도는 SPAD-502 (Minolta Japan)을 이용하였고, 엽록소 형광은 chlorophyll fluorometer (OS-30p, Opti-sciences, USA)을 이용하여 측정하였다.
광합성 관련 형질
과산화수소 엽면 처리에 대한 광합성 능력 변화를 알아보기 위하여 상대습도 44.3% (±5.8), 대기 온도 34°C (±1.6), 광량 589.7 μm·m-2·s-1 (±192.1), 이산화탄소 농도 412.4 ppm (±9.8)의 조건에서 광합성 측정기(CID-340, Bio-Science, USA)를 이용하여 이식 후 30, 49, 63, 77, 91일에 오전 11시부터 오후 2시 사이에 생리 조사와 동일한 엽 위치에서 측정하였다.
과산화수소 함량 및 항산화 활성
수수 유묘가 3 엽기에 도달하였을 때 10 mM 과산화수소를 엽면 처리하여 1시간, 6시간, 12시간, 24시간, 48시간, 72시간 차에 각각 수수 유묘 시료를 수집하여 시간별 엽내 과산화수소 함량 조사하였으며, 포장 실험에는 과산화수소 엽면 처리 2주 후, 수분 조건 및 과산화수소 처리 별 무작위로 5개체를 수집하여 엽내 과산화수소 함량(Xu et al., 2015)과 엽내 항산화 활성(Ou et al., 2001)을 분석하였다.
단백질 발현 변화
단백질 추출
한발 처리 2주 후, 수분 조건 및 과산화수소 처리 별로 수집된 수수 잎을 액체 질소로 분말화하였다. 분말 5 g 정도를 15 ml 튜브에 넣고 80% 아세톤으로 1회 세척하고 원심분리하여 상징액을 제거하고 공기 건조한 후 페놀 법(Wang et al., 2008)을 응용하여 단백질을 추출하였다. 건조된 단백질에 lysis buffer (7 M Urea, 2 M Thiourea, 4% CHAPS, 40 mM DTT)를 넣어 상온에서 1시간 반응시킨 다음 원심분리하여 상징액을 1.5 ml 튜브에 옮기고 -80°C 이하에서 보관하였다.
이차원 전기영동
추출한 단백질은 Bradford 법으로 정량하였으며(Bradford, 1976), Kim et al. (2008)의 논문을 응용하여 추출한 단백질 900 μg을 Protein IEF Cell (Bio-Rad)에서 rehyration 및 focusing을 수행하였다. Focusing이 완료된 단백질을 평형화시킨 다음, 12%의 SDS gel (185×200×1.0 mm) 위에 얹어 Protean II XI 전기영동장치(Bio-Rad)를 이용하여 전기영동을 하였다. 전기영동이 완료된 gel을 Coomassie brilliant blue G-250 (Genomic Base) 용액에서 24시간 동안 염색하였다(Yokozaki et al., 2001; Park et al., 1999; Béroud & Soussi, 1997; Birchmeier & Behrens, 1994; Ji et al., 2002).
질량 분석기(MALDI-TOF-TOF)를 이용한 단백질 동정
Coomassie brilliant blue로 염색된 젤에서 차이가 나는 단백질 부분을 젤에서 분리해 3차 증류수와 50% acetonitrile 용액으로 각각 세척 하였다. 그리고 100% acetonitrile를 가한 후, 여기에 0.1 M ammonium bicarbonate을 포함하는 acetonitrile 용액으로 15분간 세척 후 건조하였다. 건조된 젤 조각에 10 mM dithioreitol을 포함하는 0.1 M ammonium bicarbonate을 가하여 56°C에서 45분간 반응시킨 후 용액을 제거하고 55 mM iodoacetamide을 포함하는 0.1 M ammonium bicarbonate 용액을 가하여 암조건에서 30분간 반응시킨 후 용액을 제거하고 0.1 M ammonium bicarbonate를 포함하는 acetonitrile으로 15분간 세척 후 다시 건조하였다. 건조된 젤 조각에 12.5 μg/μl 트립신 용액 20 μl넣고 37°C에서 16~19시간 동안 가수분해시킨 후, 가수분해된 단백질을 추출한 다음, 질량분석기(MALDI-TOF-TOF) 및 MS-FIT 검색 프로그램인 UniProt (https://www.uniprot.org)과 NCBI (https://www.ncbi.nlm.nih.gov) 데이터베이스를 이용하여 단백질을 동정하였다(Roovers et al., 2001).
통계 분석
조사별로 얻어진 데이터는 SAS 프로그램(ver. 9.3. Cary, USA)을 이용하여 PROC ANOVA로 분산분석을 실시하고 DMRT (Duncan’s multiple range test)를 통해 p < 0.05 수준에서 평균값을 비교하였다.
결과 및 고찰
수수 생육 및 수량 관련 형질 조사
생육 조사
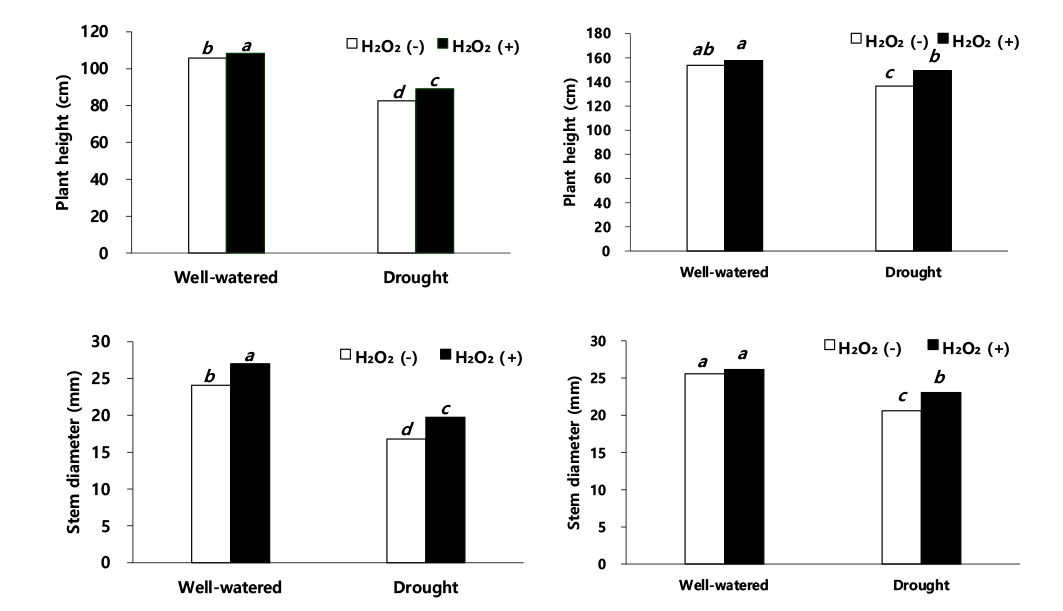
수수 이식 30일 후 생육 조사 결과(Fig. 1), 적습+H2O2 처리가 가장 우수한 것으로 나타났다. 적습+H2O 처리에서 수수 초장은 적습+H2O2 처리 대비 2.4% 감소하였고, 한발+H2O2 처리와 한발+H2O 처리는 각각 17.8%, 23.9% 감소율을 보였다. 따라서 한발+H2O 처리에서 초장이 가장 큰 감소율을 보였다(Fig. 1). 줄기 하단부 직경은 한발+H2O2 처리와 한발+H2O 처리에서 적습+H2O2 처리 대비 각각 26.8%, 37.7% 감소한 것을 보였다(Fig. 1).
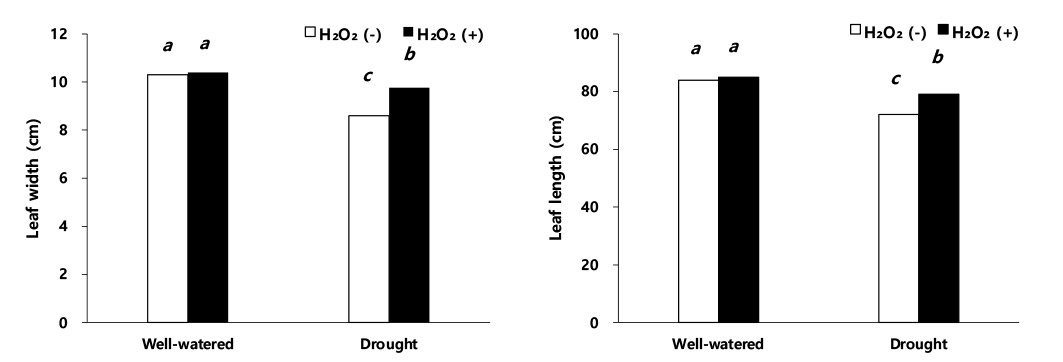
이식 60일 후 초장과 줄기 직경(Fig. 1)은 적습+H2O2 처리에서 가장 높았다. 초장과 줄기 직경은 적습+H2O2 처리 대비, 적습+H2O 처리에서 각각 2.5%, 2.3% 감소하였고, 한발+H2O2 처리에는 각각 5.7%, 11.8% 감소하였다(Fig. 1). 한발+H2O 처리는 적습+H2O2 처리 대비, 초장과 줄기 직경이 각각 13.3%, 21.4%로 가장 큰 감소율을 보였다(Fig. 1). 이식 60일 후, 적습+H2O 처리에서 엽폭과 엽장은 적습+H2O2 처리 대비 각각 1.0%, 1.2% 감소, 한발+H2O2 처리는 적습+H2O2 처리 대비, 각각 5.8%, 6.9% 감소, 한발+H2O 처리는 적습+H2O2 처리 대비, 각각 17.3%, 15.2%으로 한발+H2O 처리에서 가장 큰 감소를 보였다(Fig. 2).
수량 관련 형질 조사
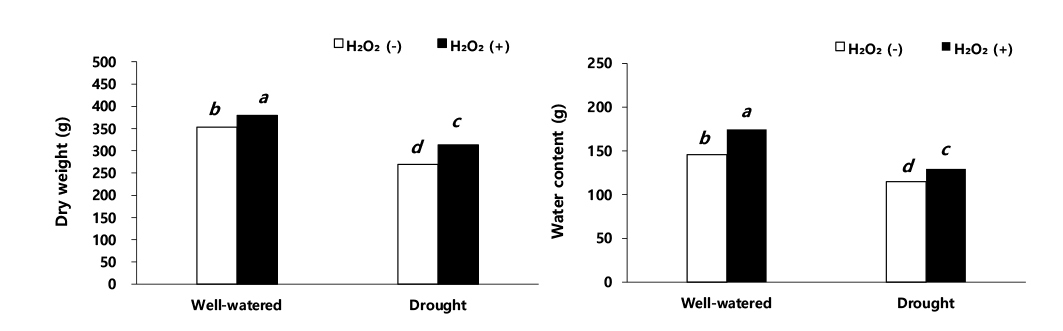
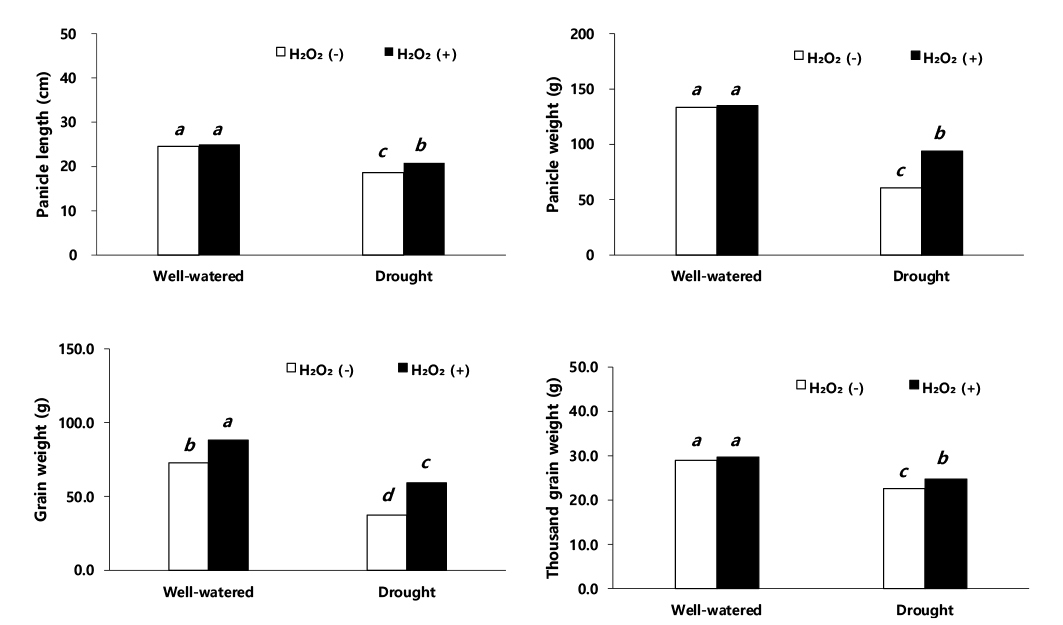
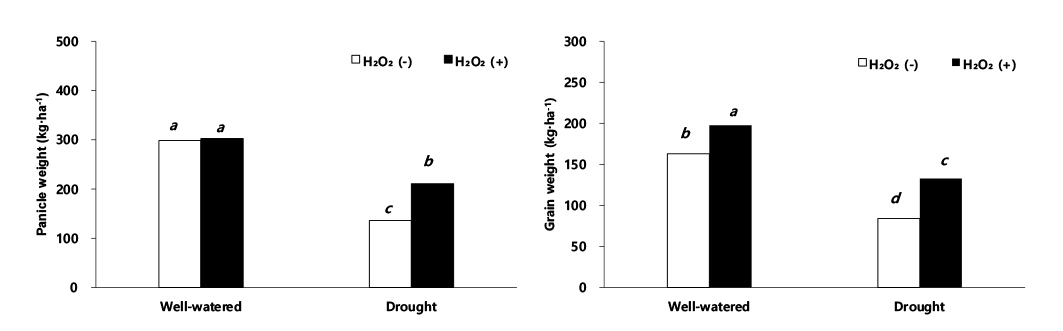
수수의 수량 관련 형질 및 수량 결과를 보면 이삭 길이, 수분 함량, 건물중, 이삭중, 주당 종실중, 단위면적당 이삭중, 단위면적당 종실중 그리고 천립중에서 적습+H2O2 처리가 가장 높았다(Figs. 3, 4, 5). 적습+H2O2 처리 대비, 이삭 길이는 적습+H2O 처리(1.6%), 한발+H2O2 처리(16.8%), 한발+H2O 처리(25.6%) 순으로 낮았다(Fig. 6). 식물체의 수분 함량은 적습+H2O2 처리 대비, 적습+H2O 처리는 7.1%, 한발+H2O2 처리는 17.4% 감소율을 보였고, 한발+H2O 처리가 29.2%로 가장 많이 감소하였다(Fig. 3).
적습 조건에서 H2O 처리와 H2O2 처리 간의 수분 함량은 유사하였으나, 한발 조건에서 H2O 처리와 H2O2 처리 간의 수분 함량은 11.8% 차이를 보였다. 이는 한발+H2O2 처리가 한발+H2O 처리보다 식물체 수분 함량이 높은 것으로써 과산화수소 처리 때문에 식물체 수분 감소를 억제한 것으로 사료 된다. Saglam et al. (2014)는 식물체 수분 함량은 작물의 수분 흡수력, 증산에 의한 손실 정도 및 체내의 수분 퍼텐셜과 밀접한 관련이 있으며, 한발 조건에서 과산화수소 처리가 식물 체내 수분 감소를 억제하여, 대사 작용들이 원활하게 유지할 수 있었다고 한다. Seki et al. (2007)은 옥수수에 과산화수소를 처리하였을 때, 잎의 수분 퍼텐셜 증가 및 삼투압 유지, 가용성 당 함량, 프롤린 및 폴리아민과 같은 삼투 조절에 관여하는 대사 물질을 증가시켜 수분 스트레스 적응에 기여했다고 한다. 본 연구에서도 과산화수소 엽면 처리가 식물 체내 수분 함량 유지에 도움을 준 것을 확인할 수 있었다(Fig. 3).
수수 지상부 건물중은 적습+H2O 처리가 적습+H2O2 처리 대비, 0.9%로 가장 낮은 감소율을 보였고, 한발+H2O 처리가 29.3% 가장 높은 감소율을 보였다(Fig. 4). Hattori et al. (2005)는 한발 스트레스(-2.0 MPa)에서 수수 지상부 건물중은 77.0%, 지하부 건물중은 85.2%로 전체 건물중이 79.5% 감소하였다고 보고하였다. 이러한 결과는 본 연구의 결과와 같은 경향이었다.
이삭중은 적습+H2O2 처리 대비, 적습+H2O 처리와 한발+H2O2 처리, 한발+H2O 처리에서 각각 1.5%, 30.4%, 54.8% 차이를 보였다(Fig. 4). 종실중은 적습+H2O2 처리 대비, 적습+H2O 처리는 17.5% 낮은 감소율을 보였고, 한발+H2O 처리가 57.5% 높은 감소율을 보였다(Fig. 4). 이는 옥수수(Saglam et al., 2014), 벼(Djanaguiraman et al., 2006), 콩(Yushi et al., 2011), 보리(Fu et al., 2003)에서 한발 스트레스로 인한 광합성 감소와 뿌리를 통한 수분 흡수 저해로 인하여 식물체 건물량이 줄어든 것과 본 연구와 일치하며, 또한 과산화수소 처리가 옥수수(Saglam et al., 2014), 콩(Abass & Mohamed, 2011)에서 수용성 당 함량과 폴리아민의 증가로 활성산소종 소거로 인하여 막을 보호하고 삼투 조절을 통해 건물량을 증가시키는 효과를 보인 것(Seki et al., 2007)과 동일한 결과가 나타났음을 확인하였다.
재식밀도를 고려한 단위면적당 이삭중은 적습+H2O2 처리 302.7 kg·ha-1, 적습+H2O 처리 298.8 kg·ha-1로 유의한 차이를 보이지 않았다. 하지만 한발+H2O 처리는 136 kg· ha-1으로 이삭중이 가장 낮았으나, 한발+H2O2 처리는 210.6 kg·ha-1으로 한발+H2O 처리보다 높았다(Fig. 5). 단위면적당 종실중은 적습+H2O2 처리가 197.5 kg·ha-1으로 가장 높았고, 적습+H2O 처리는 163.0 kg·ha-1로 확인되었다. 한발+H2O 처리 단위면적당 종실중은 적습+H2O 처리 대비 48.5% 감소한 84.0 kg·ha-1 한발로 수량감소 폭이 컸으며, 한발+H2O2 처리는 적습+H2O 처리 대비 18.6% 감소한 132.7 kg·ha-1로 한발+H2O 처리보다 29.9% 증가한 것으로 나타났다(Fig. 5). 천립 중은 적습+H2O2 처리 대비, 적습+H2O 처리 2.3%로 유의한 차이가 없었으나, 한발+H2O2 처리에는 16.8%, 한발+H2O 처리에는 23.9% 감소로써 한발+H2O 처리가 가장 높았다(Fig. 5).
과산화수소 처리가 수량 형질에 미친 영향을 적습 조건에서 H2O2 처리와 H2O 처리를 비교했을 때, 과산화수소 처리에서 이삭 길이(1.6%), 수분 함량(14.7%), 건물중(0.9%), 이삭중(1.5%), 주당 종실중(17.5%), 단위면적당 이삭중(1.3%), 단위면적당 종실중(17.5%) 및 천립중(2.3%)은 증가하였으나 유의성 있는 차이는 나타나지 않았다. 그러나 한발 조건에서 H2O2 처리와 H2O 처리를 비교한 경우, 이삭 길이(8.8%), 수분 함량(5.2%), 건물중(18.0%), 이삭중(24.8%), 주당 종실중(24.7%), 단위면적당 이삭중(35.4%), 단위면적당 종실중(36.7%) 및 천립중(7.1%)은 뚜렷하게 증가하였다. 이와 같은 결과는 H2O2 처리가 H2O 처리보다 한발 스트레스 하에서 수량성 회복에 긍정적인 영향을 준 것으로 생각된다. 이와 동일한 결과로 한발 스트레스에 민감한 콩은 한발 스트레스 하에서 초장, 협수, 종실수 및 종실중의 감소가 크게 발생하고, -0.01 MPa의 토양 조건에서 주당 종실중은 61.7 g 였지만, -0.09 MPa에는 10% 감소한 55.5 g, -0.15 MPa (강 한발)에는 54.5% 감소한 28.1 g의 결과를 보였다고 한다(Lee et al., 2004), 그리고 밀은 관수량을 절반으로 줄이면 토양으로부터 수분 흡수가 저해되어, 초장 30.0%, 이삭 길이 16.1%, 이삭수 14.0%, 주당 종실중 26.5%, 천립중 18.8% 감소(Abdel-Motagally & El-Zohri, 2016)하고 수수와 동일한 C4 식물인 옥수수 또한 ha당 종실 수량이 50% 관개와 10% 관개에서 각각 62.9%, 82.6% 수량 감소가 발생했다고 한다(Fischer et al., 1989). Tuinstra et al. (1997)은 수수를 멕시코 건조지역에서 재배한 결과 관수 시험구 수확량은 2,038 kg·ha-1였으나, 무관수 시험구 수확량은 관수 시험구 수확량보다 41.0% 감소한 1,201 kg· ha-1으로 나타났다. 본 실험에서도 한발에 따른 수수의 주당 종실중 및 단위면적당 종실중의 감소율이 각각 40%, 48.5% 내외의 차이를 보였다.
생리적 형질 조사
엽 녹색도(SPAD) 및 엽록소 형광(Fv/Fm)
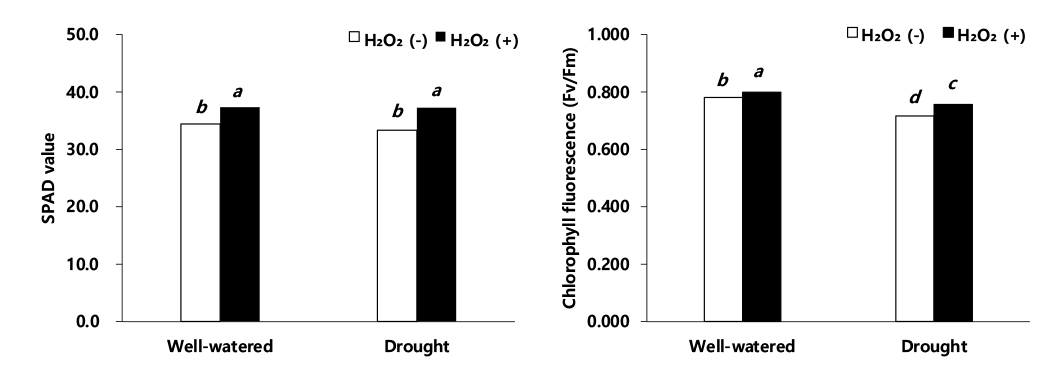
SPAD는 식물체를 손상시키지 않고 녹색도에 근거하여 비교적 쉽게 잎의 엽록소 함량을 보여주는 값으로서 이식 30일 후, SPAD 값은 적습+H2O2 처리 대비, 한발+H2O2 처리에서 0.2%의 감소, 적습+H2O 처리는 7.7% 감소, 한발+H2O 처리는 10.7% 감소로 한발+H2O 처리가 가장 큰 감소율을 보였다(Fig. 6). 광합성 효율 및 광계 II의 활성을 나타내는 지표인 엽록소 형광(Fv/Fm)은 이식 30일 후 적습+H2O2 처리 대비, 적습+H2O 처리에는 2.4%, 한발+H2O2 처리에는 5.5%, 한발+H2O 처리에는 10.4%로 한발+H2O 처리가 가장 낮은 엽록소 형광을 보였다(Fig. 6).
광합성 관련 형질
옥수수(Azevedo Neto et al., 2005; Saglam et al., 2014), 콩(Yushi et al., 2011), 벼(Djanaguiraman et al., 2006), 및 오이(Woo et al., 2006) 등에서 생육 초기에 고온 또는 염, 한발 스트레스 조건에서 과산화수소의 처리로 인하여 광합성 증진 효과가 나타났다는 보고에 따라, 생육 초기의 스트레스 내성 연구로써 본 연구에서도 수수 유묘에 과산화수소를 엽면 처리하였다.
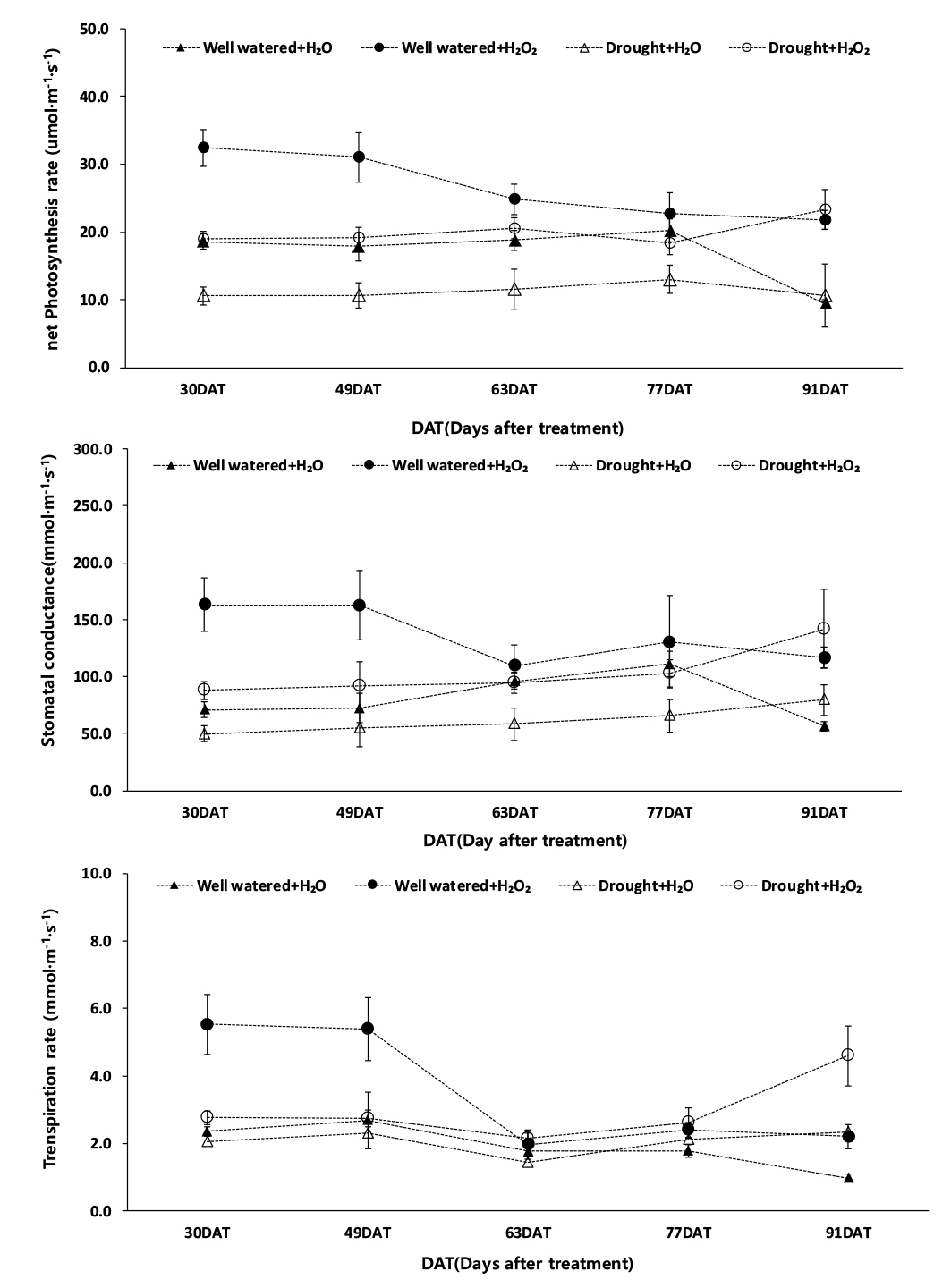
과산화수소 처리 이후 시기별 광합성률은 적습+H2O2 처리가 가장 높았고(최대치 24.8 μmol·m-2·s-1, 최소치 21.8 μmol·m-2·s-1), 한발+H2O 처리가 가장 낮았다(최대치 13.0 μmol·m-2·s-1, 최소치 10.6 μmol·m-2·s-1) (Fig. 7). 시기별 기공전도도는 적습+H2O2 처리가 가장 높았으며(최대치 130.2 mmol·m-2·s-1, 최소치 109.6 mmol·m-2·s-1), 한발+H2O 처리는 최대치 79.7 mmol·m-2·s-1, 최소치 54.8 mmol·m-2·s-1로 가장 낮았다. 시기별 증산율은 적습+H2O2 처리가 최대치 3.4 mmol·m-2·s-1, 최소치 2.1 mmol·m-2·s-1로 가장 높았고, 한발+H2O 처리가 최대치 2.3 mmol·m-2·s-1, 최소치 1.4 mmol·m-2·s-1로 가장 낮았다.
그리고 이식 30일 후, 광합성률은 적습+H2O2 처리 대비, 적습+H2O 처리와 한발+H2O2 처리에서 각각 42.7%, 41.4%의 감소율을 보였고, 한발+H2O 처리에서는 67.4%로 가장 큰 감소율을 보였다(Fig. 7). 기공전도도와 증산율도 적습+H2O2 처리가 가장 높았고, 적습+H2O2 처리 대비, 한발+H2O2 처리 기공전도도와 증산율은 각각 46.1%, 50.1%로 낮은 감소율을 보였으나, 한발+H2O 처리 기공전도도와 증산율은 각각 69.5%, 62.8%로 높은 감소율을 보였다(Fig. 7). 한발 스트레스로 인한 기공 폐쇄와 광합성 감소는 초장, 줄기 직경, 잎 생장의 감소로 이어지는 직접적인 원인이 된다(Chaves et al., 2009). 한발로 인한 기공 폐쇄는 이산화탄소 확산 저항 증가, 광계II 활성 및 광인산화 활성의 저하, RuBP의 재생 저해로 이어져 광합성이 감소한다고 알려져 있다(Boyer, 1970; Hsiao, 1973; Costa et al., 2000). 본 연구에서 한발 스트레스로 인하여 수수의 광합성률 감소를 확인할 수 있었고(Fig. 7). 잎의 기공 전도도와 증산율이 한발 스트레스로 인하여 적습 조건보다 낮았음을 알 수 있었다.
Yushi et al. (2011)은 콩에서 과산화수소 엽면 처리가 한발 스트레스에 대한 반응성을 완화해, 한발로 인한 기공 폐쇄를 상대적으로 반감시켜 한발+H2O2 처리 광합성률과 증산율이 한발+H2O 처리보다 높았다고 보고했다. Gregorio et al. (2012)는 과산화수소 처리로 인하여 세포 발달 향상 및 세포벽 이완 효과를 보였고, 2단계는 세포 확장 조절로 종실 및 과육 생장을 높일 수 있다고 하였다. 과산화수소 엽면 처리를 하게 되면 한발 조건이 매우 심하더라도 항상 일정 수준의 기공 개도가 유지되어 한발 조건에서도 이산화탄소 흡수가 가능하여 정상적인 광합성이 이루어질 수 있게 된다고 한다(Brestic et al., 1995). 본 실험 결과도 과산화수소 엽면 처리가 무처리보다 한발 조건에서 시기별 광합성률과 기공전도도가 높은 것을 확인할 수 있었다.
과산화수소 엽내 함량과 항산화 활성 변화
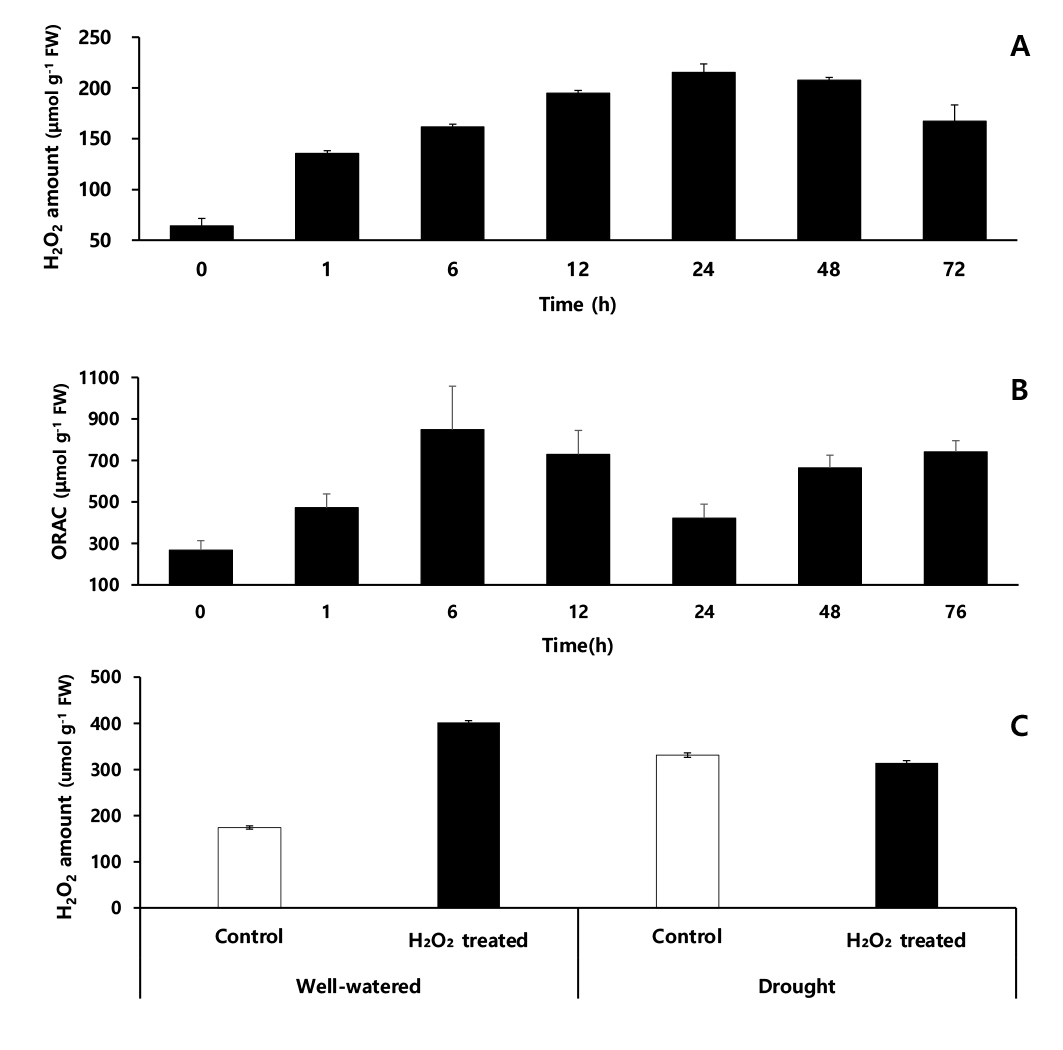
과산화수소 함량은 10 mM 과산화수소 처리 직전(0시간)에는 64.2 μmol·g-1에서 분무 1시간 후는 0시간 대비 2.1배 증가하였고, 24시간 후, 214.5 μmol·g-1으로 0시간 대비 3.4배 증가하여 48시간까지 유지하다가 이후 감소하는 경향을 보였다(Fig. 8A).
항산화 활성을 분석한 ORAC assay 결과, 과산화수소 처리 전 267.5 μmol·g-1에서 처리 후 1시간은 0시간 대비 1.8배 증가, 6시간 후는 847.3 μmol·g-1으로 처리 전 대비 3.2배 증가 후, 24시간 후는 422.4 μmol·g-1으로 감소한 뒤, 항산화 활성이 다시 높아졌다(Fig. 8B). 작물에 대한 과산화수소 처리에 관한 연구는 최근까지 많은 연구가 진행되고 있다(Byun & Choi, 2003; Woo et al., 2006; Woo et al., 2005). Lu & Higgins, 1999에 따르면 토마토에 1 ~ 2% 저농도 과산화수소를 처리하면 과산화수소가 토마토 체내로 흡수되나, 고농도 과산화수소(250 mM, 500 mM, 750 mM)를 처리하면 6 ~ 9시간 사이에 세포 괴사가 유도된다고 하여 처리 농도가 매우 중요한 요소임을 보고하였다.
본 연구는 수수 유묘에 10 mM 과산화수소(저농도)를 엽면 처리하면 약 1시간 후 수수 잎에 묻어 있던 과산화수소는 흡수 및 증발하는데 이때 수수 내 과산화수소 함량은 과산화수소 처리 전(0시간)보다 67.2 μmol·g-1이 증가하여 약 0.7%의 과산화수소가 수수 잎을 통해 엽 내로 흡수된 것으로 보인다. 또한 과산화수소 엽면처리 과정에서 토양으로 흡수된 과산화수소 용액이 수수 뿌리를 통해 체내로 흡수되었다고 가정하면, 항산화 활성이 가장 높은 처리 6시간(847.3 μmol·g-1)에 과산화수소가 0.7% 이상을 흡수된 것으로 사료된다. 이후 생성된 과산화수소 58.3 μmol·g-1은 엽면 처리 및 뿌리를 통해 흡수된 과산화수소에 의해 엽 내에서 생성된 활성산소종의 과산화수소로 추정된다. 과산화수소 처리에 따른 흡수된 과산화수소 함량과 활성산소종으로 생성된 과산화수소 함량. 그리고 과산화수소 분해 효소 작용으로 제거되는 과산화수소 등의 복합적인 요소가 관여하기 때문에 명확하게 흡수되는 과산화수소 함량을 구분하기는 어렵다(Lu & Higgins, 1999).
엽면 처리 2주 후 수수 엽 내 과산화수소 함량은 적습+H2O 처리가 174.4 μmol·g-1으로써, 적습+H2O2 처리는 적습+H2O 처리보다 과산화수소 함량보다 2.3배 더 많은 402.2 μmol·g-1으로 확인되었다. 한발+H2O 처리 과산화수소 함량은 적습+H2O 처리 대비, 89.8% 증가한 331.1 μmol·g-1인 반면, 한발+H2O2 처리 과산화수소 함량은 적습+H2O2 처리 대비, 21.8% 감소한 314.4 μmol·g-1이었다(Fig. 8C). 수수는 H2O2 엽면 처리 때문에 적습 조건에서 엽 내 과산화수소 함량이 H2O 처리보다 227.8 μmol·g-1 높았지만, 한발 조건에는 H2O2 처리가 H2O 처리보다 16.7 μmol·g-1 낮은 과산화수소 함량을 보였는데. 이는 H2O2 엽면 처리 때문에 유도된 항산화 효소 등 활성산소종을 효과적으로 분해하여 엽 내 과산화수소 함량이 낮은 것으로 보인다. 이러한 결과는 옥수수에서 한발 스트레스를 받으면 엽 내 과산화수소 함량은 증가하고, 한발 감수성 품종이 한발 내성 품종보다 체내 과산화수소 함량이 높게 측정되었다(Li et al., 1998)는 결과와 유사하다. 그리고 오이 잎에서 한발 스트레스 전, 과산화수소 엽면 처리가 과산화수소 축적을 완화 시켰다고 하며, 내부에서 발생하는 과산화수소 농도는 한발 스트레스 하에서 전자 전달체계에 발생하는 활성산소종으로 과산화수소와 이를 분해하는 효소 및 비효소적 작용에 따라 양적 차이가 발생한다고 한다(Liu et al., 2010). 과산화수소 엽면 처리 때문에 증가한 과산화수소 분해 효소들이 한발 스트레스 하에서 발생한 활성산소종인 과산화수소를 빠르게 분해하여 과산화수소 함량은 감소시킨 것으로 보이며, 본 연구에서도 과산화수소 엽면 처리로 인하여 한발 스트레스에 대한 저항성이 커지며 한발에 의해 일어나는 이차 피해를 막아주는 역할을 한 것으로 보여진다(Yushi et al., 2011). 이것은 저농도(10 mM)의 과산화수소 처리가 엽내 항산화 능력을 높이고 한발 스트레스로 유도되는 활성산소종을 효율적으로 제거할 수 있게 하여 작물 생육 및 광합성 능력 등이 저하됨을 방지하였기 때문이라고 생각된다.
단백질 발현 변화
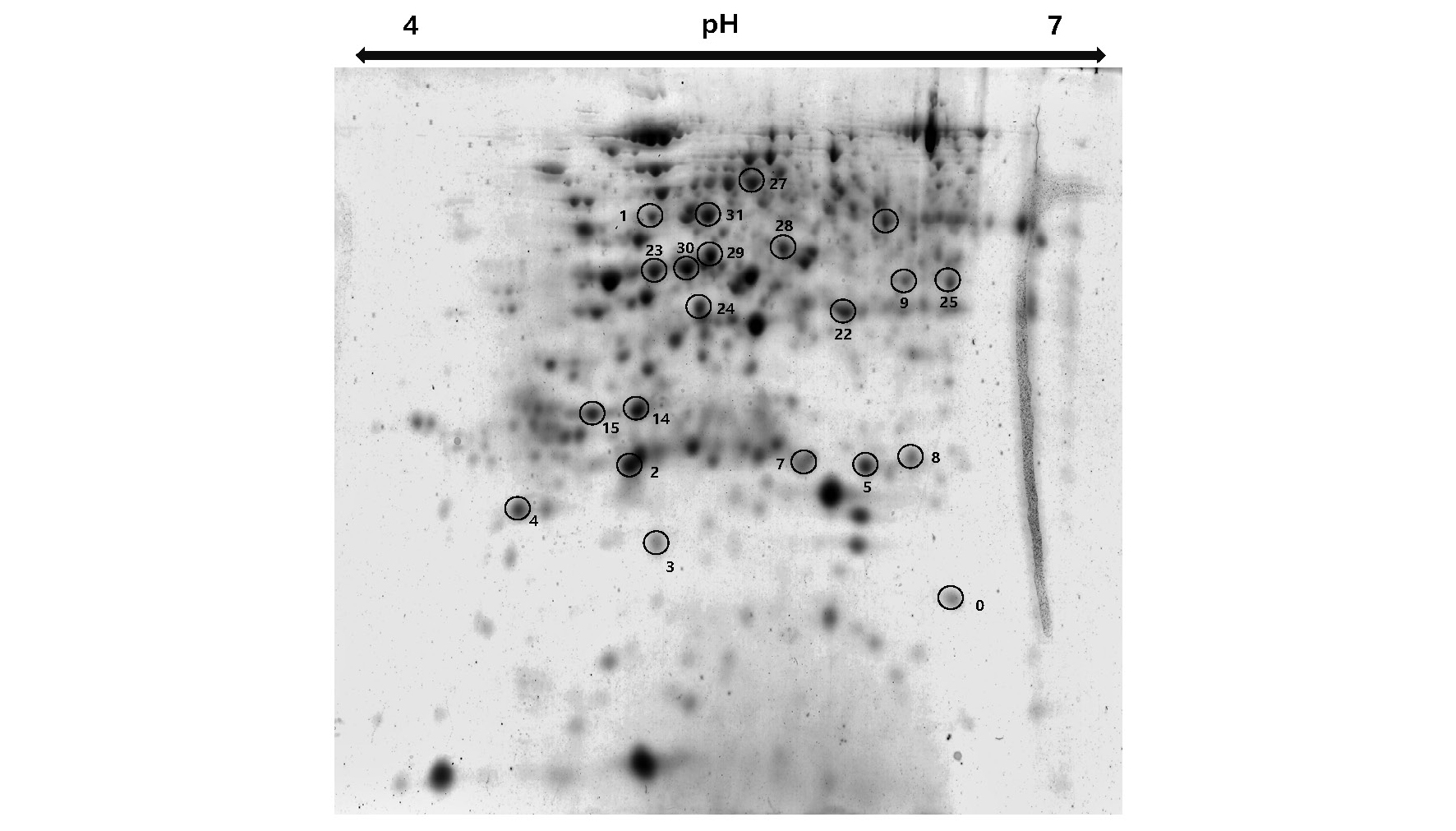
과산화수소 엽면 처리가 한발 조건에서 수수 내 어떠한 단백질의 발현을 유도하여 한발에 적응됨을 알아보기 위하여 이차원전기영동기와 질량분석기(MALDI-TOF-TOF)를 이용하여 단백질 동정을 하였다. 한발-H2O 처리에서 증가한 단백질은 glutamine synthetase (23, 30), ATP synthase subunit alpha (31), malate dehydrogenase (29)가 많이 동정 되었다(Fig. 9, Table 1). 위와 같은 단백질은 한발 조건에서 옥수수에서 과발현되는 단백질로 Kim et al. (2015)에 의해 보고되었으며, 특히나 Malate de hydrogenase (MDH)는 탄수화물 생합성과 관련 대사 단백질이며, 한발 조건에서 수박 뿌리와 포도나무에서도 과발현되었다고 한다(Cramer et al., 2013). ATP synthase subunit alpha는 광합성과 연관되어있는 단백질로써 적습 조건보다 한발 조건에서 ribulose bisphosphate carboxylase/oxygenase activase와 더불어 많이 발현된다. 그리고 한발 스트레스 조건에서 광합성을 유지하기 위해 필요한 단백질이기도 하다(Kim et al., 2015; Ali et al., 2006).
Table 1.
Major proteins changed by 10 mM H2O2 treatment in sorghum leaves under drought condition.
한발+H2O2 처리에서 증가한 단백질은 ATP synthase deltal chain (4), cytochrome b6-f complex iron-sulfur subunit (5), ATP synthase subunit gamma (25), putative uncharacterized protein Sb02g002690 (7,9), Sb07g027500 (2)와 같이 주로 광합성 관련 단백질의 발현이 증가하였다. 또한, 에너지 대사와 관련하여 해당작용에서 중요한 대사 효소인 fructose bisphosphate aldolase (FBA, 22)의 발현도 증가하였다. FBA는 옥수수와 애기장대에서 염 스트레스 및 한발 스트레스를 받았을 때 FBA mRNA 농도가 증가한다고 보고되었다(Lu et al., 2012; Hu et al., 2012). 그리고 한발+H2O2 처리가 된 수수 엽에서 superoxide 라디칼을 제거해주는 superoxide dismutase (3) 동정 및 발현 증가가 확인되었다. 일반적으로 식물 조직에서 산소 소비량의 1~2% 정도가 초산소(O2•-)가 생성되는데, 엽록체의 광계 I은 활성 산소종에 대해 민감하다. O2•-는 세포막에 가장 심각한 상해를 입힐 가능성이 있는 활성 산소종 중 하나로써, O2•의 생성은 OH•와 같은 반응성 높은 활성산소종 형성을 촉진해서, 과산화 반응으로 지질 막 파괴 및 세포 약화를 초래한다. 광계I에서 주로 생산된 초산소는 superoxide dismutase와 ascorbate peroxidase를 포함하는 일련의 항산화 효소 작용에 의하여 해독될 수 있는데(Asada, 1999), 항산화 효소 중 SOD는 환경 스트레스에서 민감하게 반응하여 환경 스트레스로 인하여 활성산소종이 증가하였을 때 많이 발생하는 효소로 알려져 있다(Apel & Hirt, 2004). 그러므로 과산화수소 처리 때문에 생성된 활성산소종을 제거하기 위해 SOD의 발현이 이루어졌고, 한발 조건에서 무처리 수수 잎보다 과산화수소 처리 후 한발 스트레스를 받은 수수 잎에서 SOD 발현량이 증가하였다. Li et al. (1998)은 한발 조건에서 한발 내성 옥수수 품종의 SOD 함량이 한발 감수성 옥수수 품종 SOD 함량보다 많았다고 한다. 이는 과산화수소 처리가 SOD 발현량을 증가하여 한발 내성을 높여준 것과 같은 결과이다.
한발 및 산화 스트레스와 같은 다양한 스트레스 조건에서 단백질의 침전을 막아주는 역할을 하는 26.6 kDa 열충격단백질(heat-shock protein, 0)도 한발+H2O2 처리에서 과발현되었다. 열충격단백질(heat shock proteins)은 분자량을 근거로 분류하는데 100 kDa 이의 고분자량열충격단백질(high molecular mass HSPs), Hsp90 (81~90 kDa), Hsp70 (65~80 kDa), Hsp60 (55~64 kDa), Hsp40 (35~54 kDa) 및 34 kDa 이하의 작은 열충격단백질(sHsps: small heat shock proteins)로 분류한다(Agashe & Hartl, 2000). 이러한 열충격단백질들은 다양한 스트레스 조건에서 단백질의 침전을 막아주고 구조적 특성을 유지시켜 주는 역할을 한다. 한발 스트레스 하에서 불활성화될 수 있는 단백질을 보호하고 또한 불활성화된 단백질을 복원하는 역할을 통해 스트레스 내성을 높여준다(Agashe & Hartl, 2000). 열충격단백질의 합성을 유도하는 세포들은 주로 내열성 개선으로 치사에 해당하는 온도에 노출되어도 견딜 수 있으며, 수분 결핍, ABA 처리, 상처, 저온 그리고 염분과 같은 다른 광범위한 환경 스트레스나 조건에 의해서도 유도될 수 있는 것으로 알려져 있다(Lee et al., 2009; Jakob et al., 1999; ). 또한 고농도의 과산화수소 처리는 세포 내에서 SAPK/JNK (Stress- activated protein kinase/c-Jun NH2-terminal kinase) 및 caspase-3의 활성을 동반하여 apoptosis나 괴사와 같은 세포 사멸을 유도하는 것으로 알려져 있으나, 저농도의 과산화수소 처리는 열충격단백질과 같은 분자 샤페론으로 발현되기도 한다(Kim et al., 2001). 따라서 본 연구도 과산화수소 처리를 통해 발현되었던 열충격단백질이 한발 조건에서 발생하는 단백질 변성을 신속하게 막아주는 역할로 작용하여 한발 적응성을 높여준 것으로 보인다.
적 요
본 논문은 과산화수소 엽면 처리를 통해 수수에서 한발 스트레스 완화 효과가 있는지 알아보기 위하여 과산화수소 처리에 따른 생육 및 생리적 특성 변화와 단백질 변화를 분석하였다.
1.포장 실험에서 한발 스트레스는 수수 생장을 감소시켰으나, 과산화수소 처리구에서는 과산화수소 무처리구보다 생육이 우수하였다. 또한 한발 조건에서 과산화수소 처리는 무처리에 비해 수량 관련 형질들의저하를 막는 효과를 보였다.
2.엽 녹색도(SPAD) 및 엽록소 형광(Fv/Fm), 광합성 형질 조사에서 과산화수소 처리가 과산화수소 무처리보다 높았고, 포장 실험에서 엽내 과산화수소 함량은 적습+H2O2 처리가 적습+H2O 처리보다 과산화수소 함량이 227.8 μmol·g-1 높았고, 한발 조건에서 엽내 과산화수소 함량은 한발+H2O2 처리가 한발+H2O 처리보다 16.7 μmol·g-1으로 낮았다.
3.한발 조건에서 과산화수소 처리는 여러 단백질의 발현을 변화시켰으며, 특히 광합성 관련 단백질인 ATP synthase deltal chain, cytochrome b6-f complex iron-sulfur subunit, ATP synthase subunit gamma, putative uncharacterized protein Sb02g002690, Sb07g027500와 Superoxide 라디칼을 제거해주는 superoxide dismutase가 증가한 것을 확인하였다. 그리고 단백질 보호와 복원에 관련된 heat shock protein의 발현 증가도 확인되었다.
종합적으로 과산화수소 엽면 처리가 한발 하에서 광합성 관련 단백질의 발현을 증가와 기공 개도를 높여 광합성 능력을 향상시켰다. 특히 엽내에 축적될 수 있는 활성산소종을 제거하는 항산화 능력이 높아져 한발 스트레스 대한 내성을 높여 수수의 생육과 수량성 저하가 억제되는 것을 확인할 수 있었다.