서 론
재료 및 방법
재배방법 및 재식밀도의 조절
생육, 수량 및 도복지수 조사
주요 유리당함량 분석
통계분석
결과 및 고찰
재식밀도별 파종 후 일수에 따른 생육 특성
재식밀도에 따른 수량, 유리당 함량 및 도복위험성
생육 및 수량 요인간 다변량 분석
적 요
서 론
단수수는 생육기간이 약 4개월로 짧아 우리나라에서 2기작이 가능하고(Choi et al., 2012), 광합성 능력이 높은 C4 작물로 C3 작물에 비해 양·수분을 효율적으로 이용하여 한계지역에서의 생장이 가능하며(Anten et al.., 1995), 원료 당(Bian et al.., 2006; Carpita & McCann, 2008), 사료화(Dar, 2006), 곡실(Ahn et al.., 2012) 등 용도가 다양하다. 특히 수수(Carpita & McCann, 2008), 옥수수(Savallios et al.., 2008), 억새, 갈대, 우뭇가사리(Bok et al.., 2010) 등과 함께 바이오에너지 작물로 유망하게 평가받아 왔는데, 이중 단수수는 광합성 효율 및 셀룰로오스 함량이 타작물에 비해 높아 바이오에너지 생산에 적합(Gibson, 2009; Gnansounou et al.., 2005)한 것으로 평가받고 있다(Carpita & McCann, 2008).
작물의 재식밀도는 작물 생산성에 크게 영향을 미치므로 대부분의 관행적인 작물 관리방법에서 핵심적인 요소이다(Hiltbrunner et al.., 2007). 적정 재식밀도는 수관 내 미세환경과 광합성능을 향상시키며 잎의 노화를 지연시키고(Dong et al.., 2012; Yang et al.., 2014), 지상부의 바이오매스 축적량을 약 22~33% 증가(Dai et al.., 2015; Wang et al.., 2015)시키는 등 광 이용 효율을 높여 잠재적인 바이오매스 생산량을 높인다(Yao et al.., 2015). 반면 적정밀도 이상의 재배는 개체간 경쟁을 유발하여 엽장 및 줄기 직경, 순동화율의 감소(Cipollini & Bergelson, 2001) 등과 같은 악영향을 초래할 수도 있다(Leskovsek et al.., 2012). 또한 최적의 재식밀도는 식물의 유전형과 토양조건 및 수분 공급과 같은 유전·환경적 요인에 의존적으로 변화하기도 한다(Cusicanqui & Lauer, 1999).
단수수는 비교적 재배가 용이하고 다양한 이점이 있음에도 불구하고, 국내 생산은 통계적으로 보고되지 않을 만큼 미미한 수준이며, 2008년 이후 농촌진흥청을 중심으로 다양한 측면의 연구가 진행되어 왔으나, 값싼 당원료 수입으로 인한 수요 저조, 생산‧가공체계 미비, 성숙기 태풍(또는 강한 바람)에 의한 도복 피해, 외국 단수수 품종 및 사탕수수에 비해 낮은 당도 등의 여러 재배‧산업적 원인에 의해 재배가 확대되지 못하고 있는 실정이다. 특히 수수와 달리 수체 내 수액의 생산이 주목적인 단수수는 개화기 전후의 광합성 효율이 중요(Martin & Kelleher, 1984)함에도 불구하고 안정생산에 관한 국내 관련연구가 전무한 실정으로 재배를 시도하는 농업인의 영농에 어려운 점이 많은 편이다.
본 연구는 단수수의 재식밀도에 따른 생육, 수량 및 품질을 비교하고 수량과 관련된 요인간 다변량 분석을 통해 안정 재배를 위한 기초자료를 확보하고자 수행하였다.
재료 및 방법
재배방법 및 재식밀도의 조절
시험포장의 토성은 모래, 미사, 점토의 함량이 각각 42.0, 20.2, 37.8%인 식양토로 조사되었다. 토양의 화학성은 pH가 6.6으로 생육에 적합한 중성의 범위였으며, EC는 0.74 dS·m-1, 유기물 18.3 g·kg-1로 유기물은 적정범위(20~30 g·kg-1)보다 다소 낮은 수준이었다. 유효인산은 513 mg·kg-1 (150~250), 치환성 칼륨 0.70 cmolc·kg-1 (0.45~0.55)으로 적정 범위보다 높았으며, 칼슘과 마그네슘은 각각 7.01, 1.55 cmolc·kg-1 수준이었다.
실험재료인 단수수 ‘초롱’은 2017년 3월 국립식량과학원 바이오에너지연구소에서 분양받은 종자를 사용하였으며, 2018년 5월 25일, 72공 육묘용 플러그트레이에 원예용상토를 이용하여 파종한 후 6월 11일 이식까지 약 17일간 상온조건에서 육묘하였다. 육묘 후 4×2 m의 시험구에 열간격을 60 cm로 고정하였으며, m-2당 재식밀도를 16.7, 11.1, 8.3, 6.7, 5.6주(각각의 주간거리는 10, 15, 20, 25, 30 cm)씩 각각을 난괴법 3반복으로 배치 및 이식하였다. 이식시 묘의 상태는 초장이 18.9±1.7 cm로 병해충 피해가 없고 육안으로 판단했을 때 건전한 묘만을 사용하였다. 이식 후의 재배관리는 농촌진흥청 농업기술길잡이 “수수”(RDA, 2016)에 준하여 관리하였다.
생육, 수량 및 도복지수 조사
재식밀도별 생육의 변화를 측정하고자 초장, 경태, 분지수를 이식 4일 후(6월 15일)부터 10일 간격으로 9월 15일까지 5개체씩 3반복으로 조사하였다. 초장의 조사는 지표면 지제부에서 가장 상층부에 전개된 잎의 끝 지점까지를 측정하였고, 출수된 이후부터는 이삭목까지를 측정하였다. 경태는 지제부 바로 위 첫 번째 마디의 중간부를 가장 넓은 면과 좁은 면을 측정한 후 평균하여 산출하였으며, 분지수는 주경을 제외한 지제부에서 발생한 모든 분지를 계수하였다.
수확기 조사는 출수 후 50일이 되는 9월 23일에, 5개체씩 3반복 무작위로 채취하여 실시하였다. 초장 및 경태는 생육조사와 동일한 방법으로 하였으며, 주경의 마디수는 지제부로부터 이삭목까지 모든 마디를 계수하였다. 가용성 고형물 함량은 각 줄기의 중간부위(약 20 cm의 절편)에서 착즙하여 디지털 굴절당도계(PR-101α, Atago Co. Ltd., Japan)로 측정하였으며, 이삭과 잎을 제거하여 생경수량을 측정한 후, 얇게 잘라 60°C에서 4일간 건조하여 건물수량을 측정하였다. 또한 착즙액의 수량 및 당수량은 Wortmann et al.. (2010)의 다음 식을 적용하여 산출하였다.
CSY = (FSY – DSY) × (°Brix / 100) × 0.75
JY, 80% extracted = [FSY - (DSY – CSY)] × 0.8
SY = JY × (°Brix / 100) × 0.75
위 식에서 보존적 당수량(conservative sugar yield, CSY), 생경수량(fresh stem yield, FSY), 건물수량(dry stem yield, DSY), 착즙액 수량(juice yield, JY), 당수량(sugar yield, SY)은 hectare당 Mg (ton)으로 산출하였고, 0.75와 0.8은 각각 착즙액 내 당 농도를 나타내는 상수(°Brix의 75%)와 착즙액의 수율(착즙율)을 의미한다.
도복지수는 각 시험구 내 도복된 개체수를 계수하여 전체 주수에 대한 백분율값을 지수화하여 표현하였다. 또한 도복으로 부러지거나 쓰러져 토양표면에 닿아 수량 및 품질이 감소하는 것을 방지하기 위해 시험구 사이의 열 마다 지표면으로부터 1 m 높이를 통과하는 줄을 고정하였으며, 45° 이상 쓰러진 개체만을 도복으로 판정하였다.
주요 유리당함량 분석
유리당함량 분석을 위해 수확기 조사와 동일한 시기에 재식밀도 각 처리별 15주(분지경 포함)씩 3반복으로 수확한 후 각 줄기의 중간부위 20 cm에서 착즙액을 채취하였다. 채취한 시료는 50 mL conical tube에 희석하여 원심분리기(Centrifuge 5804R, Eppendorf AG, Hamburg, Germany)로 3,000 rpm, 10분간 원심분리한 후, 0.45 um syringe filter (Millipore, Billerica, MA, USA)로 여과하여 분석에 사용하였다. 분석은 HPLC (Shinseido Nanospace SI-2, Shiseido, Japan)와 동일회사의 refractive index detector (RID)를 사용하였으며 Column은 Unison UK-Amino (250×3 mm, 3 um, Imtakt Corp. Japan)를 사용하였고, 이 때 column 분석온도는 60°C이었다. 이동상은 water (Fisher Scientific, MA, USA) 100%로 하였으며, injection volume은 4 uL이고 flow rate는 0.4 mL·min-1이었다. 표준물질인 sucrose, glucose, fructose, lactose 및 maltose는 Sigma-Aldrich Co. (St. Louis, MO, USA) 제품을 사용하였다.
통계분석
수집된 데이터의 분석은 Windows용 SAS system release 8.01 (SAS Institute Inc, Cary, N.C., USA)을 이용하여 Duncan의 다중검정(p=0.05)과 회귀, 상관, 주성분분석을 실시하였다.
결과 및 고찰
재식밀도별 파종 후 일수에 따른 생육 특성
주경장은 모든 재식밀도(m-2당 재식주수) 처리구에서 파종 후 60일까지 급격한 신장을 보인 후 수확기까지 완만해졌으며 파종 110일(수확 전) 후에는 주경장이 222.9~231.5 cm로 처리간 차이는 보이지 않았다(Fig. 1A). 경태는 주경장보다 약 10일 정도 빠른 파종 후 50일경까지 급격한 증가 후 완만해지는 경향을 보였고, 재식밀도 16.7주·m-2 처리구가 가장 얇았으며 재식밀도가 감소할수록 증가하는 경향을 나타내었다(Fig. 1B). 본 실험에서 출수기는 모든 처리구가 파종 후 71일(8월 4일)로 조사되었는데, 주경장이 경태에 비해 약 10일 후까지 신장이 지속된 것은 출수에 따른 것으로 생각되며, 경태의 비대가 완만해지는 파종 후 약 50일경이 영양생장기에서 생식생장기로 전환되는 시기로 판단된다. 따라서 동 시기 단수수의 생장이 절간생장이나 개화‧성숙 등에 의해 조절된다는 Shukla et al.. (2017)의 보고와 일치하였다. 또한 단수수 ‘Wray’, ‘Keller’, ‘Rio’의 영양생장기는 파종 후 36~80일까지로 보고(Tsuchihashi & Goto, 2008)되었으나, 위 3품종이 열대 및 아열대 지역에서 주로 재배되는 품종인 것에 비해 ‘초롱’은 온대기후인 국내 재래종 유래 품종으로 유전적 차이에 기인하는 것으로 생각된다. 분지수의 경우 파종 후 30~40일경부터 주당 1.0~2.3개까지 빠르게 증가한 이후 감소하는 경향을 보였는데, 주경장과 경태의 생장이 최대치에 도달하는 파종 후 50일경부터 급격히 감소하였다. 분지수의 감소는 재식밀도 5.6, 6.7주·m-2 처리구가 가장 적었으며, 재식밀도가 높을수록 감소하는 시기가 빠른 경향이었다(Fig. 1C). 이와 같은 결과는 종실용 수수(Han & Yoon, 2017)와 옥수수(Lee et al.., 2004; Yoshida, 1973), 단수수(Tang et al.., 2018)의 재식밀도가 낮을수록 분얼 발생이 증가하고 유효경의 비율이 감소한다는 보고와 일치하였다.
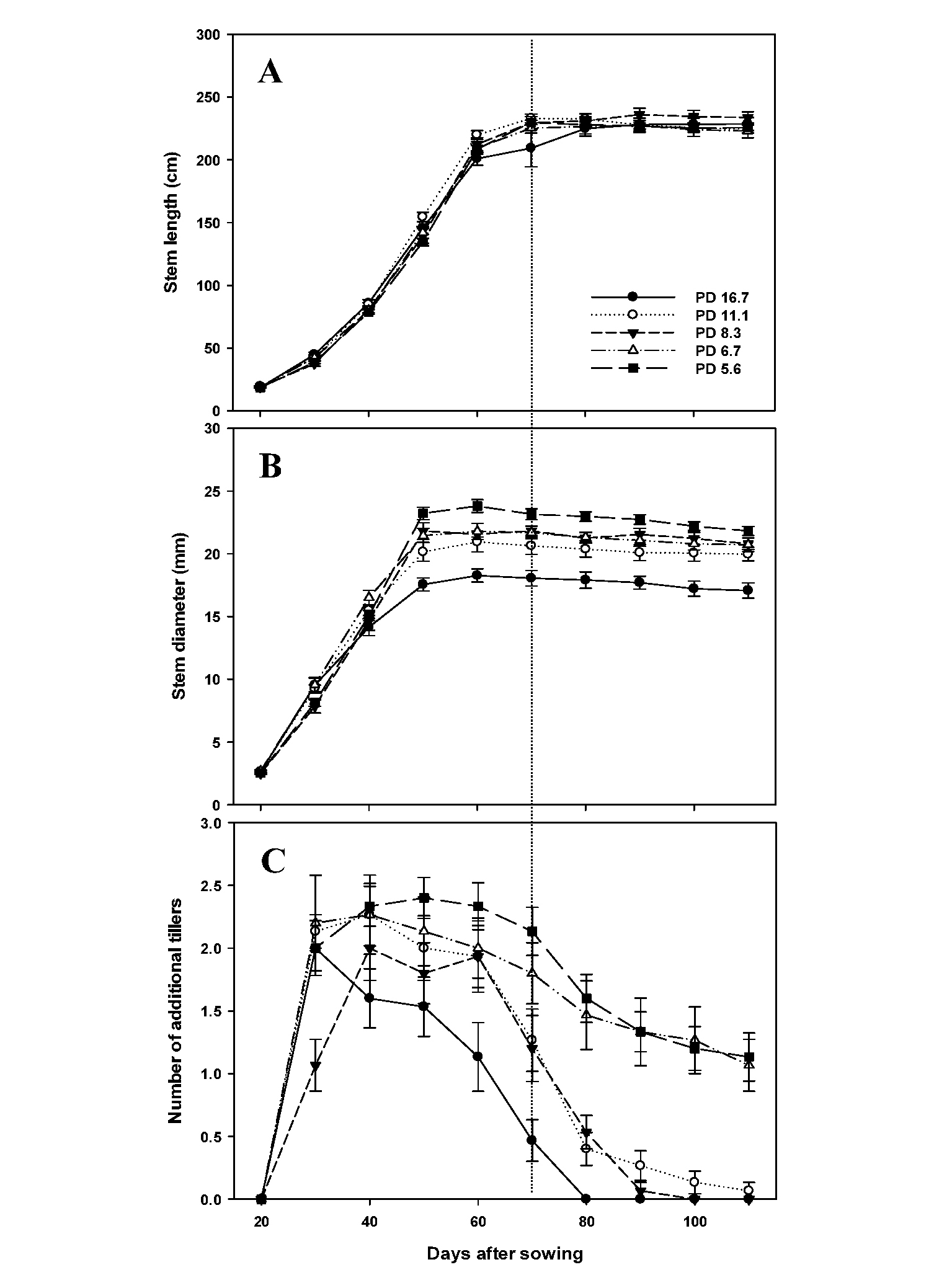
Fig. 1.
Influence of planting density on the seasonal patterns of stem length (A), diameter (B), and number of additional tillers (C) of the sweet sorghum cultivar ‘Chorong’ in 2018. Vertical bars represent standard error of the means (n = 15). Legend in the graph indicates planting density (PD) and the unit is number of plants per square meter. The dotted line represents heading date (71 days after sowing).
재식밀도에 따른 수량, 유리당 함량 및 도복위험성
파종 후 121일(출수 후 50일)이 되는 시점에 모든 처리구를 일시 수확하여 수량구성요소를 조사한 결과는 Table 1과 같다. 가용성 고형물 함량은 재식밀도 11.1, 8.3주·m-2 처리구가 각각 13.35, 13.09°Brix로 16.7주·m-2 처리구와 재식밀도가 낮은 처리구들보다 높은 편이었으나 처리간 통계적인 차이는 없었다. ha당 생경수량은 재식밀도 16.7, 11.1주·m-2 처리구가 각각 60.9, 53.3 Mg·ha-1로 가장 높았으며, 건물수량(11.97, 11.10 Mg·ha-1)도 유사한 경향을 보였다. 또한 재식밀도 16.7주·m-2 처리구는 추정한 착즙액과 당수량이 각각 42.9, 4.16 Mg·ha-1로 가장 높았고, 다음이 11.1 (37.1, 3.73 Mg·ha-1)주·m-2 처리구였다. 8.3 (30.5, 2.96 Mg·ha-1), 6.7 (26.6, 2.41), 5.6 (24.7, 2.22)주·m-2 처리구는 통계적인 차이는 없었으나 재식밀도가 높아짐에 따라 수량도 증가하는 경향을 나타내 재식밀도와 엽면적지수, 바이오매스 생산량간 정의 관계가 있다고 보고한 Tang et al.. (2018)의 보고와 유사하였다.
Table 1. Effect of planting density on yield components at harvest (50 days after heading) of the sweet sorghum cultivar ‘Chorong’.
일반적으로 재식간격이 좁을수록 초기 군락의 광 이용효율은 증가하지만 수형이 완전히 형성되고 개체간에 경쟁 상황이 되면 광합성 효율은 감소하게 된다. 본 실험에서 재식밀도가 높은 16.7, 11.1주·m-2 처리구는 출수기 전후인 파종 후 60~80일 사이에 분지수가 급격히 감소하였으나 6.7, 5.6주·m-2 처리구는 수확이 되는 시점까지 최소 분지수 1개 이상을 유지하였다. 따라서 재식밀도가 낮은 두 처리구의 분지들은 상대적으로 성숙까지의 일수가 최대 30일 이상(분지수 발생이 최고치가 되는 시점까지)이 부족하였으며, 수확기 m-2당 총 경수는 재식밀도가 높은 처리구와 유사한 수준을 나타내었다(데이터 미제시). Martin & Kelleher (1984)는 재식간격이 좁을수록 건물량과 수용성 탄수화물의 수량이 많고 이는 개화 전 광합성 생산량이 더 높기 때문에 당 축적 및 줄기의 비대에 밀접한 관련이 있다고 보고하였으며, 결과적으로 재식간격이 좁을수록 수량은 증가하였다(Turgut et al.., 2005).
유리당(Table 2)은 모든 처리구에서 fructose, glucose, sucrose, maltose가 검출되었고, fructose와 glucose는 각각 1.00~1.23, 1.69~2.16% 범위내로 처리간 차이를 보이지 않았다. 반면 비율이 가장 높았던 sucrose 함량은 재식밀도간 통계적 차이는 없었으나 가용성 고형물 함량과 마찬가지로 8.3 (9.59%), 11.1 (8.44%)주·m-2 처리구에서 높은 경향을 보였으며, 총 유리당 함량도 유사하였다. 작물의 생장상태 또는 단계는 체내 탄수화물함량에 영향을 미치는 중요한 요인인데(Naoyuki & Goto, 2004), 특히 단수수 5품종(‘Soave’, ‘Rio’, ‘Vespa’, ‘Tumo’, ‘M81-E’)의 유리당 함량 분석결과 sucrose, maltose, glucose, fructose 순으로 많고, 총 당 및 sucrose 함량과는 정의관계가 성립된다(Almodares et al.., 2008). 따라서 재식밀도가 높을수록 초기 엽면적의 빠른 확보를 통해 수량과 sucrose 함량이 높았던 것으로 판단되었다.
Table 2. Effect of planting density on sugar contents in juice at harvest (50 days after heading) of the sweet sorghum cultivar ‘Chorong’.
단수수의 착즙액과 당수량을 구하는 방법은 연구자들마다 일부 차이는 있으나 일반적으로 가용성 고형물 함량과 줄기의 수량을 기준으로 산출된다. 따라서 재식밀도가 낮은 처리구들은 줄기가 굵고 분지수가 많기는 하였지만, 재식밀도가 높을수록 분지수가 적은 반면 단위면적당 생경수량이 증가하여(비교적 가용성 고형물 함량도 높았던) 결과적으로 재식밀도가 높을수록 수량 증가에 유리하였다. 하지만 가용성 고형물 함량과 유리당 함량의 경우 통계적인 차이는 없었으나 11.1, 8.3주·m-2 처리구에서 비교적 높은 편으로 조사되었는데, 시럽과 같은 고농축액 제조 시 소요되는 착즙액의 양은 유리당 함량(또는 당도)에 의해 결정되므로 추후 보다 세밀한 분석과 품질면에서의 한계치 설정이 필요할 것으로 생각되었다.
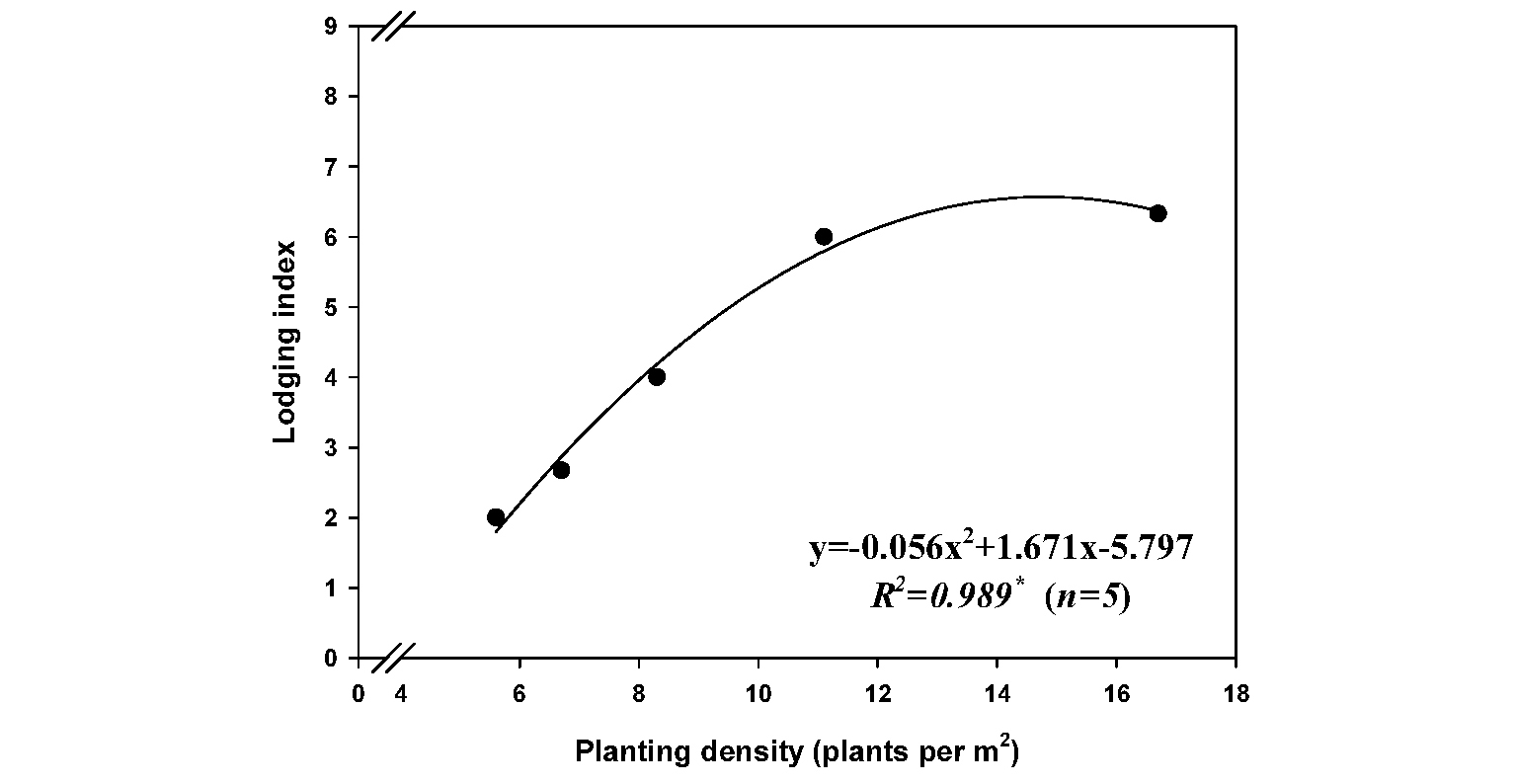
특히 재식밀도에 따른 도복지수를 조사한 결과(Fig. 2), 도복이 발생한 시점은 9월 3일(출수 후 30일경), 최대 풍속은 5.7 m·s-1 (기상청)로 상대적으로 강한 편은 아니었음에도 재식밀도가 5.6에서 11.1주·m-2까지 증가할 때, 도복지수도 2~6까지 급격히 증가하였다(R2=0.989*). 단수수의 도복은 수량감소(Fedenko et al.., 2015)는 물론 병해충 피해의 온상이 될 위험성이 크므로 재배지에서는 태풍의 도래 횟수, 강풍에 대한 위험도, 지형적 특성 등을 고려한 후 최종적으로 재식밀도를 적용해야 할 것으로 판단된다.
생육 및 수량 요인간 다변량 분석
단수수 ‘초롱’의 수확기 생육 및 품질 요인간 상관분석 결과를 산점도매트릭스로 작성한 결과(Fig. 3), 주경의 길이와 굵기, 마디 개수는 다른 요인들간 통계적 관계가 없었다. 수량을 구성하는 요소 중 하나인 가용성 고형물 함량은 당수량(r=0.49**)과 정의관계에 있고, 생경수량, 건물수량, 착즙액과 당수량간에는 모두 고도로 유의한 정의 상관관계가 인정되어 재식밀도와 수량과의 관계에 대해 보고한 Tang et al.. (2018)과 Yao et al.. (2015)의 연구결과와 일치하였다. 특히 재식밀도는 주경의 굵기(r=-0.65**)와는 부의 관계, 생경수량(r=0.62**), 건물수량(r=0.58**), 착즙액(r=0.63**) 및 당수량(r=0.66**)과는 정의 관계를 나타내었다. 주성분분석은 고유값(eigen value)이 1 이상인 주성분이 PC1~PC4 총 4개로 누적분산은 85.9%였으며, 각 주성분의 설명력은 45.2, 17.2, 12.4, 11.2%이었다(Table 3). 이중 주성분의 수효를 결정하는 누적분산 60% 이상인 PC1과 PC2의 고유값(누적분산 62.4%)을 기준으로 산점도를 작성한 결과(Fig. 4), 상관분석 결과와 마찬가지로 재식밀도, 생경수량, 건물수량, 착즙액 및 당수량은 비교적 가까운 거리에 위치하여 하나의 그룹에 속하는 것으로 조사되었다. 주경의 길이와 굵기, 마디의 개수도 가까운 위치에 있으나 수량을 결정하는 요인들과는 거리가 먼 것으로 나타났다.
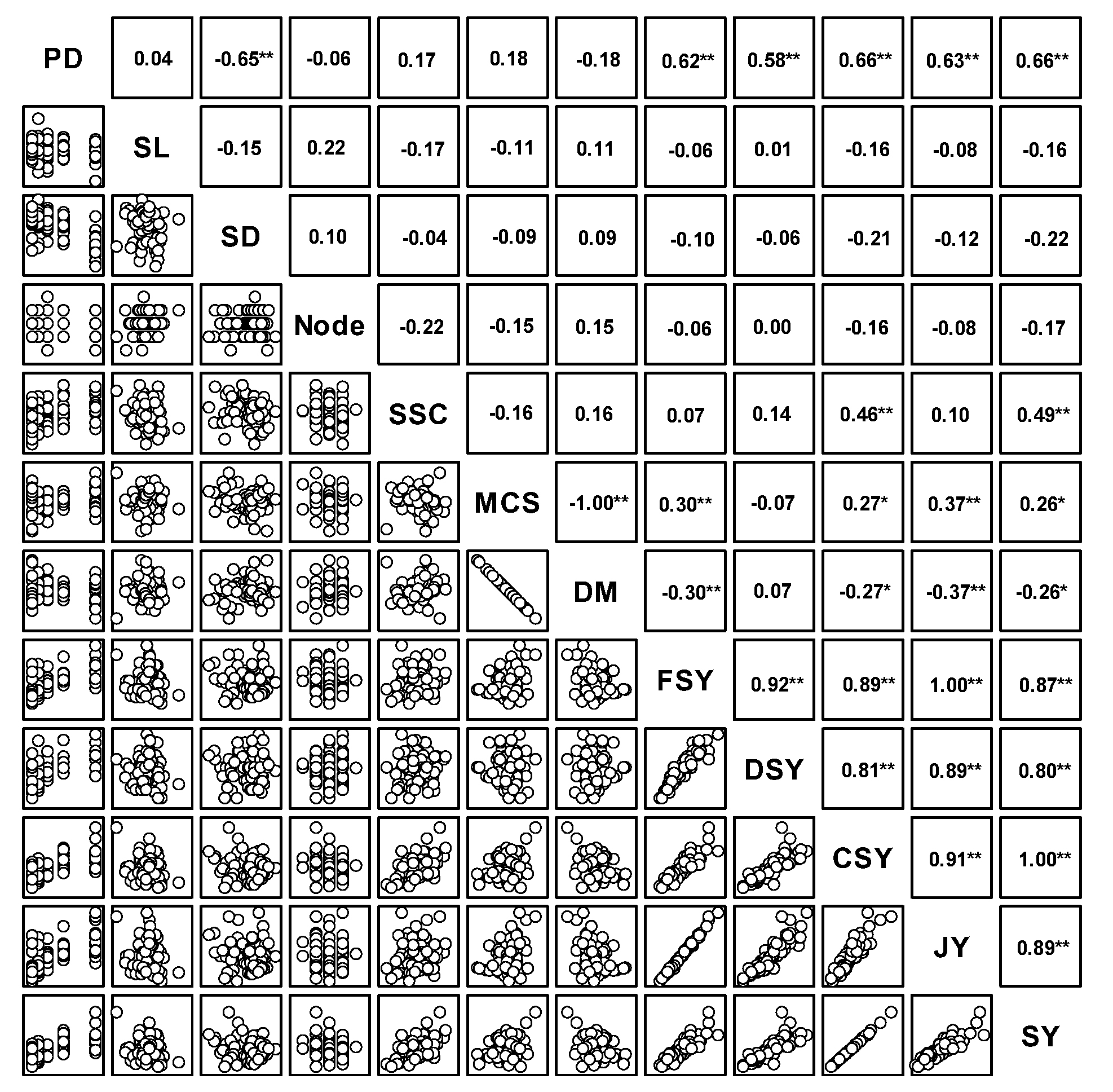
Fig. 3.
Scatter plot matrix and Pearson’s coefficient between growth and yield characteristics surveyed at harvest period of the sweet sorghum cultivar ‘Chorong’. Plant density (PD), stem length (SL), stem diameter (SD), number of nodes (Node), soluble solids content (SSC), moisture contents of stem (MCS), dry matter (DM), fresh stem yield (FSY), dry stem yield (DSY), conservative sugar yield (CSY), juice yield (JY), sugar yield (SY). **P ≤ 0.01, *P ≤ 0.05 represent significant values (n=75).
Table 3. Principal component (PC) analysis results of growth and yield characteristics of the sweet sorghum cultivar ‘Chorong’.
| Principal component | Eigen value | Variability (%) | Cumulative variance (%) |
| PC1 | 5.42 | 45.2 | 45.2 |
| PC2 | 2.06 | 17.2 | 62.4 |
| PC3 | 1.49 | 12.4 | 74.7 |
| PC4 | 1.34 | 11.2 | 85.9 |
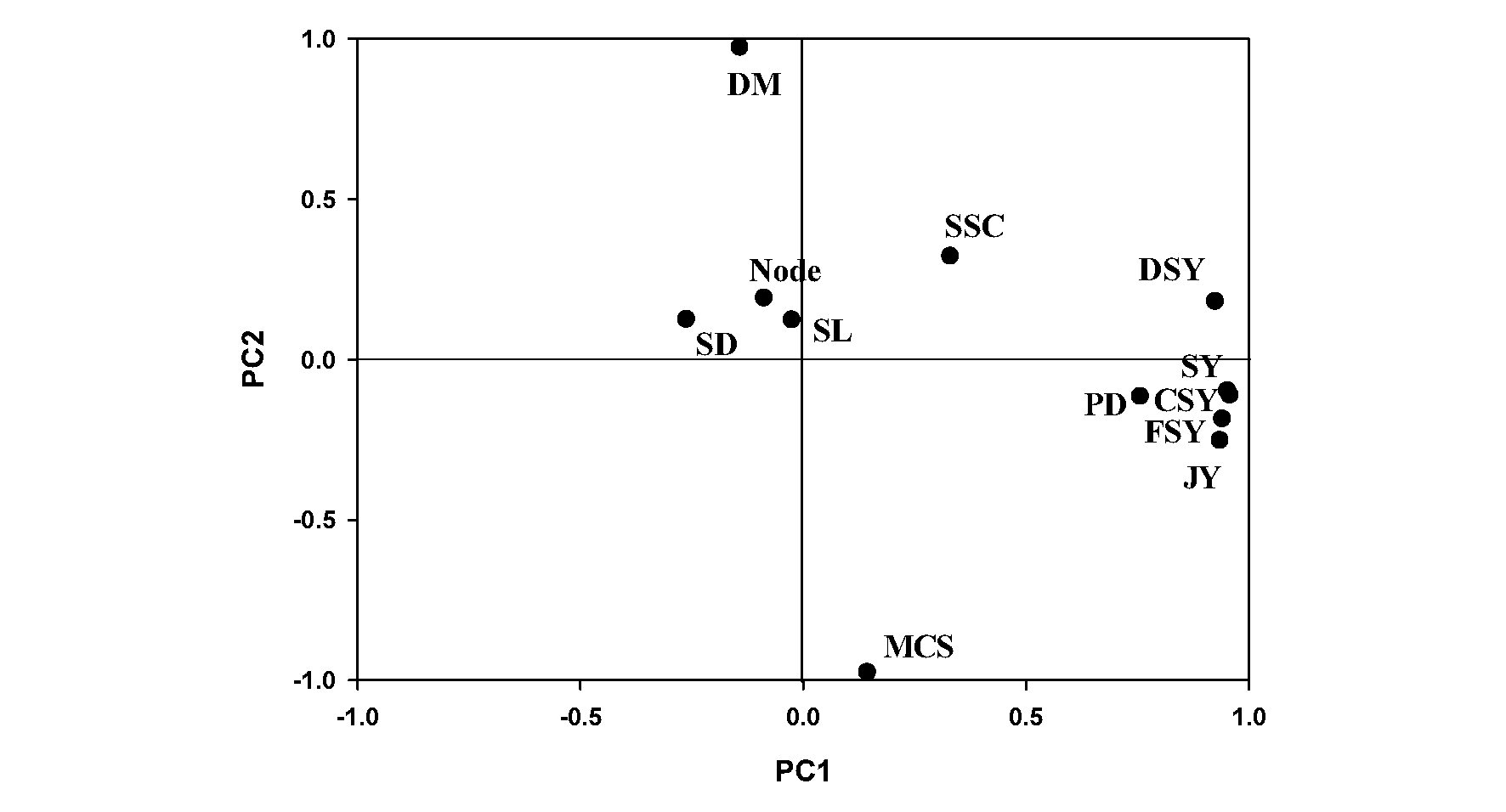
Fig. 4.
Scatter plot of growth and yield characteristics from principal components analysis at harvest period of the sweet sorghum cultivar ‘Chorong’. Plant density (PD), stem length (SL), stem diameter (SD), number of nodes (Node), soluble solids content (SSC), moisture contents of stem (MCS), dry matter (DM), fresh stem yield (FSY), dry stem yield (DSY), conservative sugar yield (CSY), juice yield (JY), sugar yield (SY).
이상의 결과를 종합해 보았을 때, 착즙액을 목적으로 단수수를 재배할 시에는 5.6~16.7주·m-2까지 재식밀도와 함께 생경수량이 증가하여 최종적인 착즙액과 당수량이 증가하였다. 하지만 통계적인 차이는 없었으나 비교적 11.1, 8.3주·m-2에서 유리당 함량이 높았고, 재식밀도가 높을수록 도복지수가 증가하는 점 등을 고려하여 최종적으로 재식밀도를 결정해야 할 것이다.
적 요
본 연구는 단수수 ‘초롱’(Sorghum bicolor (L.) Moench)의 재식밀도(16.7, 11.1, 8.3, 6.7, 5.6주·m-2)에 따른 생육, 착즙액의 수량 및 품질을 비교하고 적정 재식밀도와 다변량 분석을 통해 수량에 관계된 요인을 분석하고자 수행하였다. 재식밀도에 따라 파종 후 일수별 주경장은 처리간 차이가 없었으나 재식밀도가 높아짐에 따라 경태는 얇아지고 분지의 퇴화가 빨라지는 경향을 보였다. 수확기 추정한 착즙액과 당수량은 재식밀도가 높은 16.7 (각각 42.9, 4.16 Mg·ha-1), 11.1 (37.1, 3.73 Mg·ha-1)주·m-2 처리구가 8.3 (30.5, 2.96 Mg·ha-1), 6.7 (26.6, 2.41 Mg·ha-1), 5.6 (24.7, 2.22 Mg·ha-1)주·m-2 처리구보다 많았다. 가용성 고형물 및 유리당 함량은 통계적인 차이는 없었으나 11.1, 8.3주·m-2 처리구에서 높은 편이었다. 반면 재식밀도가 5.6~11.1주·m-2까지 증가했을 때 도복지수(9에 가까울수록 도복피해가 커짐)가 2.00~6.33까지 급격히 증가하여 최종 재식밀도의 결정시 태풍의 도래 횟수나 지형적인 특성 등을 고려해야 할 것이다. 추가적으로 조사항목간 상관분석과 주성분 분석에서 재식밀도는 생경수량(r=0.62**), 건물수량(r=0.58**), 착즙액(r=0.63**) 및 당수량(r=0.66**)과는 정의관계를, 주경의 굵기(r=-0.65**)와는 부의관계를 나타내었다. 또한 수량 관련 요인들은 초장, 경태, 마디수와 통계적 관계가 없었다.